Obsah
- Úvod
- Biomolekuly
- Enzymy a enzymová kinetika
- Sacharidy a glykolýza
- Další metabolické dráhy cukrů
- Lipidy, mastné kyseliny a jejich metabolismus
- Metabolismus tuků
- Metabolismus aminokyselin
- Metabolismus nukleotidů
Úvod
Biochemie pomáhá vysvětlovat rozmanitost přírody—všechno tvorstvo staví na několika základních principech, 20 AK, třech druzích biopolymerů... A složitost v přírodě vzniká hierarchicky kombinací těchto faktorů. Zároveň mnoho jevů, které jsou na makroúrovni těžko vysvětlitelné, má svůj základ právě v biochemii (nebo související molekulární biologii).
- L. Pasteur (19. stol.)
- položil základy biochemie
- fermentaci způsobují mikroorganismy
- každý život pochází ze zárodku (žába nevznikne z bahna)
- E. Buchner (přelom 19. a 20. stol.)
- fermentaci je schopen navodit buněčný extrakt
- popření vitalismu: to, čeho je živý organismus schopen, je možné analyzovat, není to dáno žádnou “životní silou” (vis vitalis)
- fermentace je chemický proces, je nutné se ptát, co je to na chemické úrovni \(\implies\) počátek studia glykolytické dráhy
- dostal Nobelovu cenu
- A. Harder, Hans von Euler-Chelpin
- dialýza
- do kádinky přidáme pufr
- do kádinky přidáme střívko (semipermeabiní membrána)
- přes póry projdou jen molekuly s určitou velikostí, cut-off point je několik tisíc
\(\pu{Da}\) - malé molekuly (fruktóza) přes střívkou projdou
- stejná koncentrace uvnitř i vně střívka
Zjistilo se, že velké molekuly, které přes membránu neprošly (tedy proteiny, pozn. profesora) jsou termolabilní. Došlo poprvé k separaci, frakcionaci, rozdělení kvasinek.
- dále pak výzkumy malých molekul (byly dobře dostupné), objevy vitamínů, základních metabolických drah
- J. Summer (1926)
- krystalizace proteinu ureázy z bobů: velký milník, čistý materiál, navíc uměl katalyzovat štěpení močoviny \(\implies\) proteiny jako nositelé enzymové aktivity
- popisy glykolýzy, cyklu kyseliny citrónové, určení struktury DNA, krátce na to určení krystalové struktury myoglobinu (protein z vorvaně)
- poznání transformace energie (oxidativní fosforylace), fungování buňky a regulace jejího metabolismu
- objevy všech velkých metabolických drah, počátek hledání jejich regulace
- později (90. léta–součastnost) spíše už systémové studium
- jak se soubory molekul v buňce chovají, studium celého souboru proteinů v buňkách (např. jak se liší soubory proteinů kvasinek žijících v různých podmínkách)
- studium proteomu, metabolomu, etc., pomocí molekulárně biochemických a hmotnostně spektromektických přístupů, které umožňují vše pozorovat najednou
- velký posun v popisu diverzity–víme o všem, co se organismu týká \(\implies\) můžeme skoro definitivně rozhodnout, čemu jsou organismy příbuzné, ptáme na celé soubory genů a proteinů
- stavba atomu (elektronová konfigurace základních biogenních prvků, jak dochází k hybridizaci, co jsou orbitaly, prostorová struktura v hybridizacích)
- stavba jednoduchých molekul, zejména těch založených na uhlíku
- znát jeho elektronovou konfiguraci a záležitosti hybridizace
- pouze uhlík z celé tabulky je schopen tvořit tak akorát stabilní řetězení
\(\ce{C-C-C-C-...}\) \(\ce{N-N-N-N-...}\) nestabilní\(\ce{O-Si-O-Si-...}\) až příliš stabilní
- periodické vlastnosti prvků: jak se v tabulce mění elektronegativita, velikost iontu, elektronová afinita, ionizační energie, velikost elektronového obalu
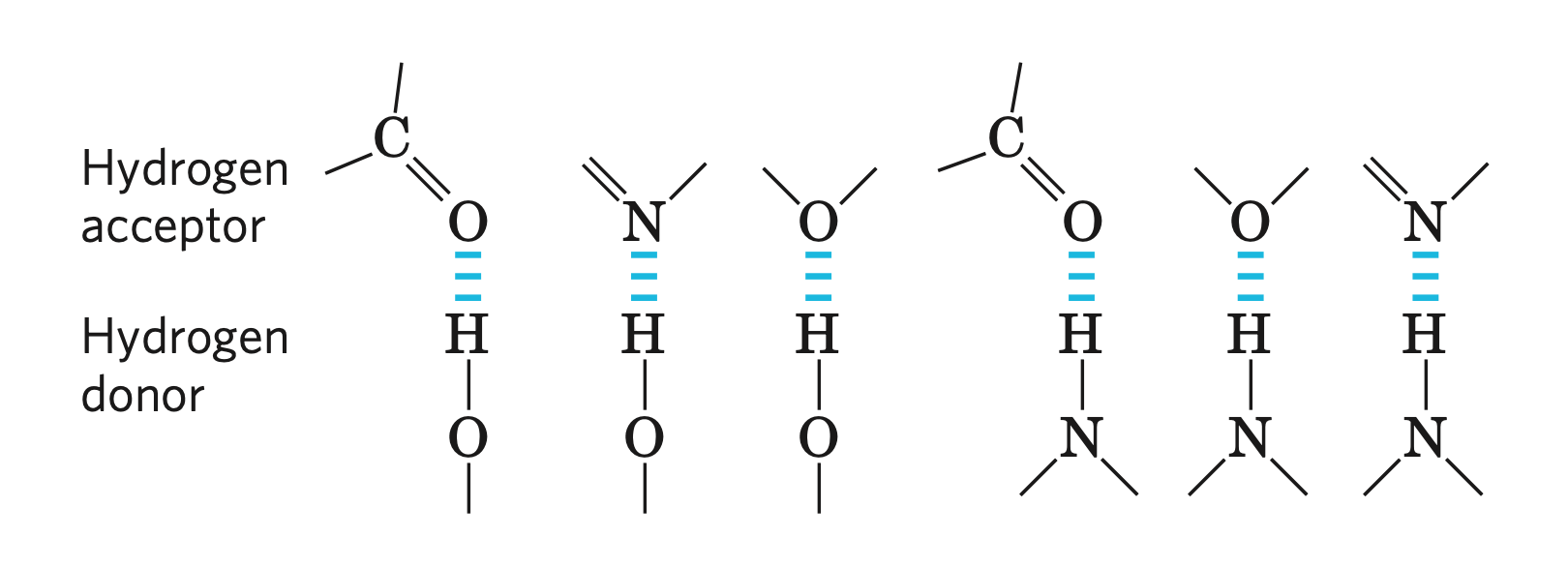
- co je to kovalentní vazba, vodíkové můstky a další interakce
- základní poznatky o chemických rovnováhách
- základy termodynamiky: první a druhý zákon, zachování energie, entropie
- kyseliny, zásady, pufry
Biomolekuly
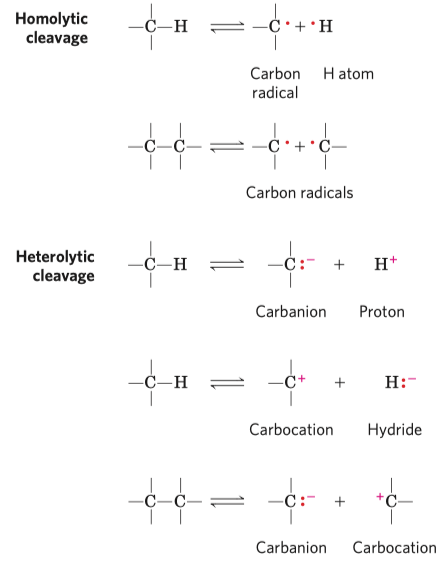
- homolytické štěpení
- vede ke vzniku radikálů, každý z účastníků vazby získává jeden elektron z vazebného páru
- heterolytické štěpení
- vede ke vzniku iontů
- heterolytickým štěpením mohou vznikat významné nukleofilní skupiny (hydroxy, amino, imidazolová, atd.) i elektrofilní skupiny (protony, ionty kovů, atd.)
V biologických systémech nejčastěji vzniká záporně nabitý
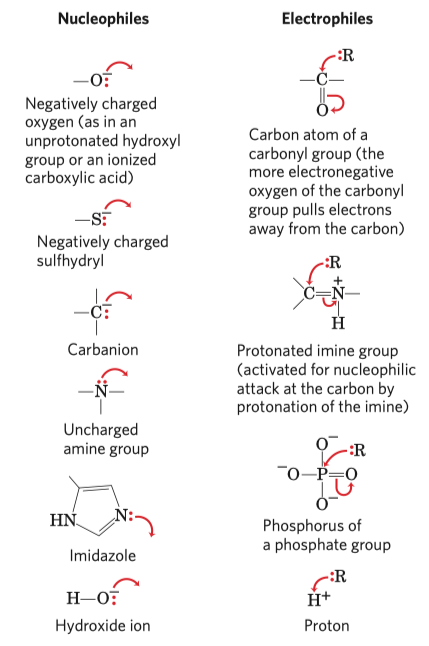
- Nukleofil
- Molekula, které přebývají elektrony, chce se jich zbavit.
- Elektrofil
- Molekula, které chybí elektrony, chtěla by nějaké dostat. Často jí jsou předány nukleofilem.
Voda
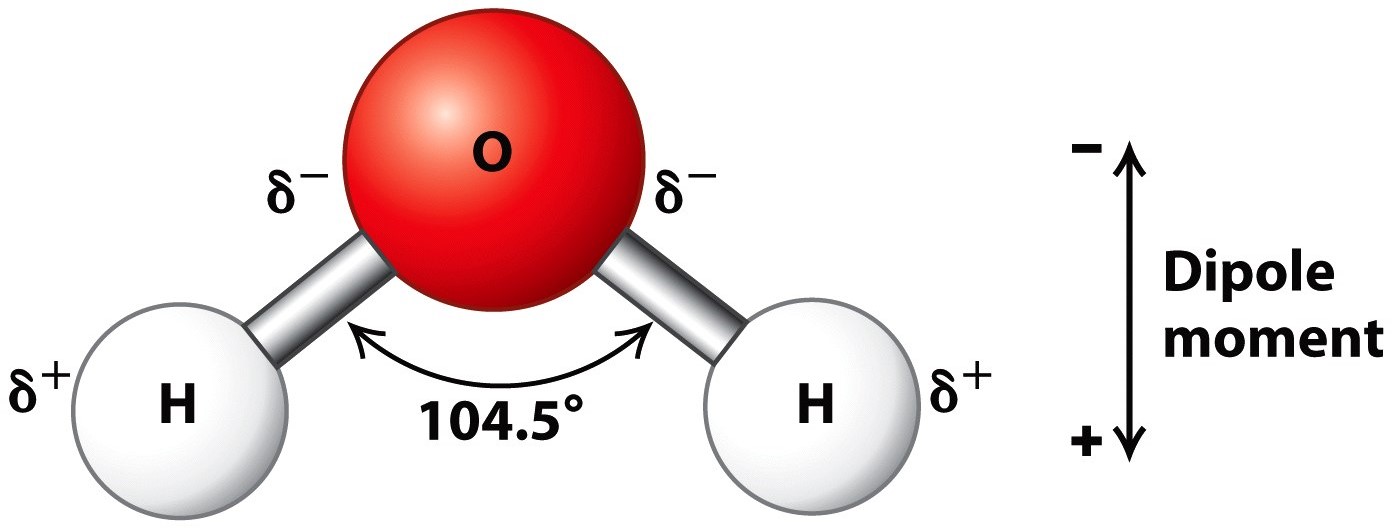
- molekula vody je asymetrická
- sp3 hybridizace: vazby směřují do vrcholů čtyřstěnu, ve dvou jsou vodíky a ve dvou nevazebné elektronové páry
- tvoří elektrický dipól: na části molekuly je parciální elektrický náboj
- kyslík je mnohem elektronegativnější, elektronegativita rozhoduje o distribuci elektronů na vazbě; kyslík přitahuje vazebný pár větší silou, elektronová hustota bude tedy posunuta ke kyslíku
- vysoká dielektrická konstanta \(\implies\) umí účinně separovat náboje
- voda je v tom v rámci běžných rozpouštědel nejlepší \(\implies\) ionty, které by spolu normálně reagovaly, se udrží ve vodě zvlášť
- vysoká tepelná kapacita (pufr planety)
- vysoká měrná skupenská tepla \(\implies\) odpařováním účinně ochlazujeme systém
- včely musí mávat křídly, když chtějí ochladit úl
- vyšší hustota vody ve srovnání s ledem \(\implies\) vodní nádrže zamrzají od povrchu
- vysoké povrchové napětí \(\implies\) týká se řady věcí
- souvisí s tvorbou vodíkových můstků
- vysoká vodivost
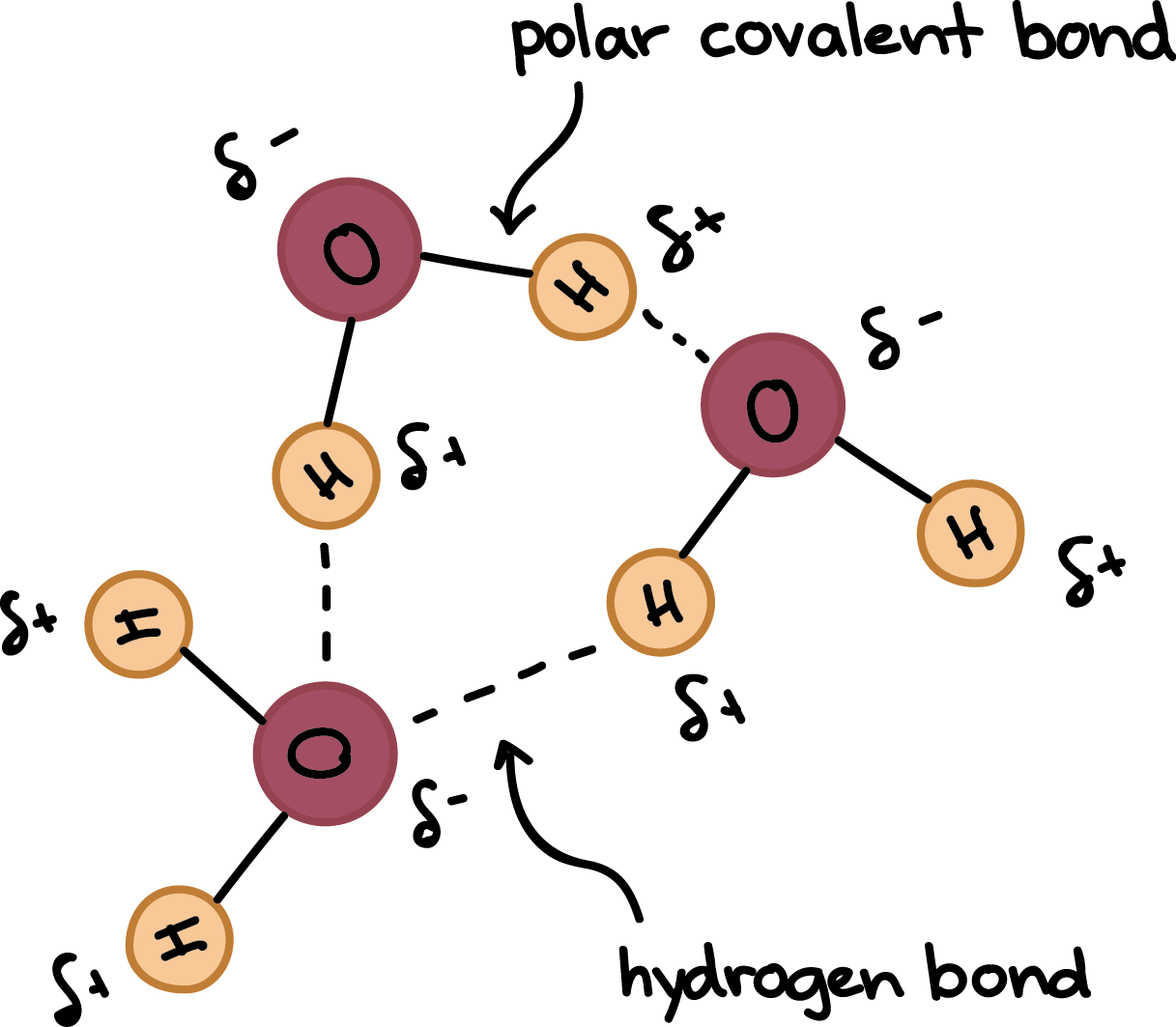
Strukturu a vlastnosti vody silně ovlivňuje tvorba vodíkových můstků.
\(\ce{O-H}\) vazba má ze 33% iontový charakter- tvoří se hlavně mezi dvěma molekulami vody
- mohou se ale tvořit i s jinými (částečně) polárními látkami \(\implies\) polární látky se ve vodě dobře rozpouštějí
- příklady skupin reagujících s vodou: hydroxylová, keto, karboxylová (dokonce se třemi molekulami)
- mohou se ale tvořit i s jinými (částečně) polárními látkami \(\implies\) polární látky se ve vodě dobře rozpouštějí
- parciálně kladně nabitý
\(\ce{H}\) se naváže na volné el. páry, které také míří do vrcholů čtyřstěnu- nic jiného než vodík není tak malé, aby to dovedlo
- energie vazby cca
\(\pu{20 kJ/mol}\) , asi o řád méně než typická kovalentní vazba (např.\(\ce{C-C}\) má asi\(\pu{350 kJ/mol}\) ).- vzniká jich ovšem mnoho, čili i přes nízkou energii mají velký vliv
- vzdálenost je jen 1.8 Å, což je méně než VdW vzdálenost (2.6 Å) bez této interakce
- každá molekula vody může vázat 4 partnery (dva jako donor, dva jako akceptor)
- u ledu tomu tak opravdu je, jeho krystaly mají hexagonální tvar \(\implies\) má nižší hustotu než voda
- v kapalině je tato vlastnost také skoro zachována: vysoké procento molekul má 4 partnery, samotní konkrétní partneři se ale stále mění
- fluktuující struktury obsahující desítky molekul: stále se tvoří a zanikají (co 10–11 sekund) \(\implies\) tvorba až sedmičlenných clusterů
- vysoká mobilita molekul; donedávna jsme netušili, jak extenzivní ty interakce jsou (jde o celou jejich síť)
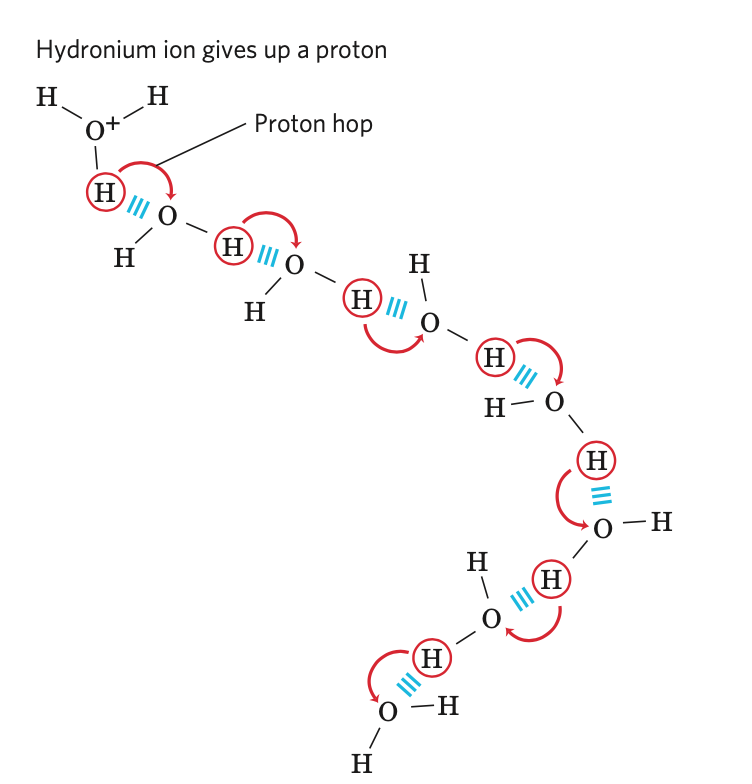
- ionty
\(\ce{OH-}\) a\(\ce{H3O+}\) jsou vysoce mobilní (viz obrázek)
- dielektrická konstanta zdaleka nejvyšší, i když ty molekuly jsou si jinak podobné
- dielektrická konstanta udává míru odporu při vytváření elektrického pole v rámci nějaké látky vzhledem k vakuu
- např. aceton je také asymetrický s dipólovým momentem \(\implies\) tento jev není způsoben dipolaritou
- má vysoká měrná skupenská tepla
- např. při odpařování musíme dodat kromě normálního tepla ještě teplo navíc, abychom rozbili H-můstky
- dobře separuje ionty \(\implies\) ve vodě mohou být látky rozpuštěné v daleko vyšší koncentraci než v jiných rozpouštědlech
- nepolární látka
\(L\) (nebo látka s nepolární částí) s vodou neinteraguje, molekuly vody jsou maximálně na VdW vzdálenost - kolem
\(L\) vzniká vrstvička vody s omezenou pohyblivostí (nemůže se k ní přiblížit) - tato vrstvička se váže přes H-můstky na další molekuly, ty zase na další, ... \(\implies\) mnoho molekul má najednou omezený počet stupňů volnosti
- systém směřuje k maximální entropii \(\implies\) molekuly se
\(L\) shlukují k sobě, v součtu tím omezí (= uspořádají) nejmenší možný počet molekul vody
Body 1. a 2. probíhají ve všech polárních rozpouštědlech, avšak chování a unikátnost vody v tomto (opět) silně ovlivňují H-můstky. Tento princip stojí za tvorbou biologických membrán. Dal by se popsat následující rovnicí
kde
- Hydrofobní kolaps
- Hypotetický způsob vzniku terciální struktury proteinů; podle této hypotézy se proteiny zfoldují na základně hydrofobického efektu popsaného výše.
Hydrofobní interakce jsou vlastně negativně vyvolané reakce: jsou vyvolané absencí přitahování molekul rozpouštědla a rozpouštěné látky
Acidobazické vlastnosti vody a kyselin
- Brønstedova kyselina
- Látka, která může poskytnout protony. Obdobně zásada je látka, která může protony přijmout. Po ztrátě protonu se Brønstedova kyselina stává svou konjugovanou zásadou.
- pufr
- Acidobazický pufr je směs slabé kyseliny a její konjugované zásady v roztoku, který má pH blízké
\(pK_a\) kyseliny.
přičemž předposlední rovnosti se říká Hendersonova-Hasselbalchova rovnice a popisuje vztah mezi složením pufru a jeho kyselostí. Pro vodu zároveň platí
což vychází z obecnější rovnice
Z měření vychází, že při 25 ° C
kde
- používá se k zjištění množství kyseliny v roztoku
- do roztoku se přidává
\(\ce{NaOH}\) (nebo jiná silná zásada) o známé koncentraci, dokud se roztok neneutralizuje - z koncentrace a objemu použité zásady se spočítá pH původního roztoku
- vývoj pH roztoku v závislosti na množství přidané zásady se zaznamnává do tzv. titrační křivky, viz obrázek
- křivku lze popsat Hendresson-Hasselbachovou rovnicí
- v inflexním bodě platí
\(\text{pH} = pK_a\) - v části, kde pH roste jen pomalu, se systém chová jako pufr
- vývoj pH roztoku v závislosti na množství přidané zásady se zaznamnává do tzv. titrační křivky, viz obrázek
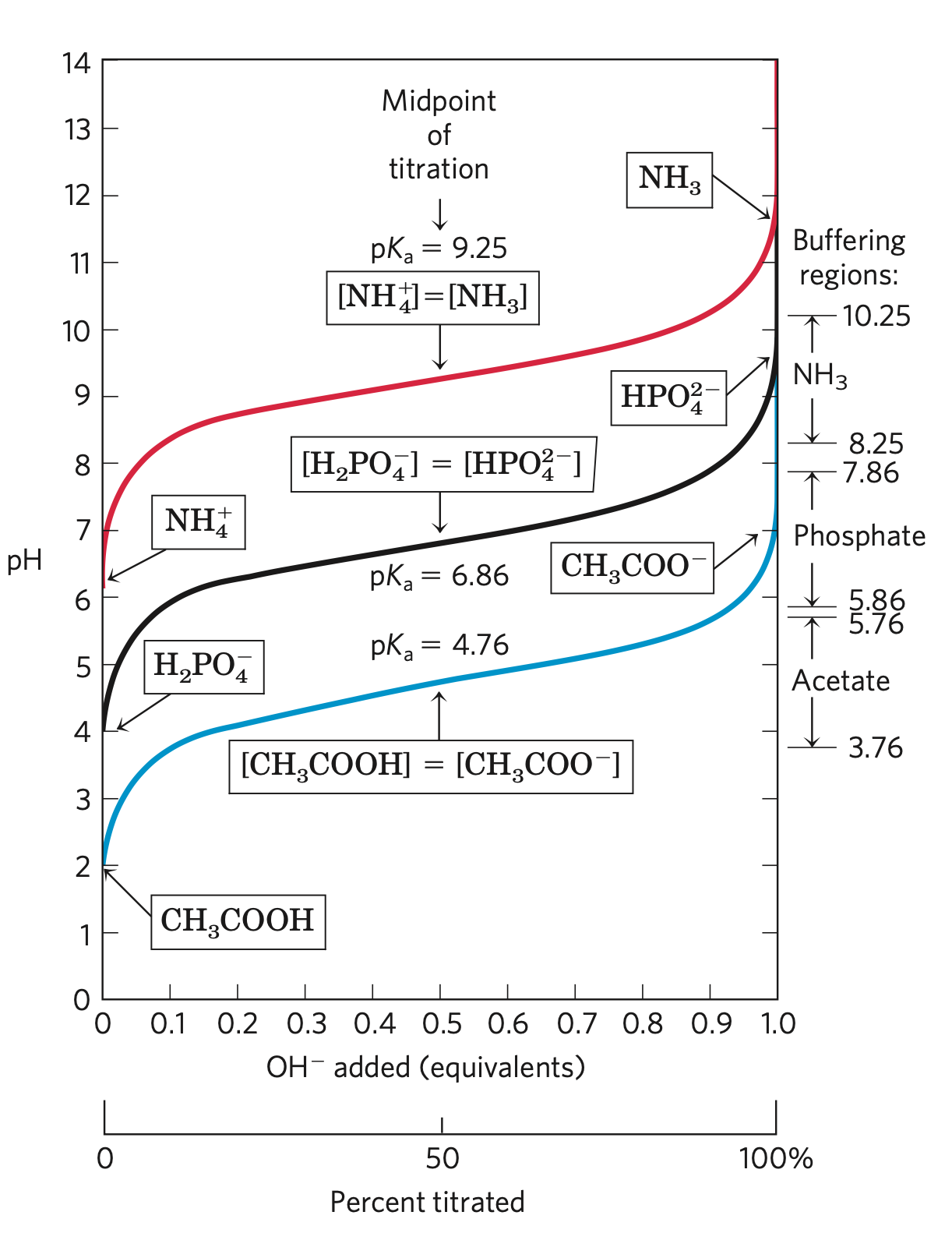
Pokud budeme vybírat pufr, musíme jej zvolit tak, aby poměr soli a kyseliny byl roven jedné právě v oblasti, ve které budeme pracovat.
- acidobazické skupiny v jedné molekule se navzájem ovlivňují
- pokud se
\(pK_a\) jejich různých ionizačních stupňů liší více než o 2 až 3 jednotky pH, můžeme je při výpočtech pH úspěšně považovat za směs jednotlivých slabých kyselin- pro polyprotní kyseliny s hodnotami pK lišícími se méně než o tuto hodnotu jsou pozorované molekulové ionizační konstanty prostě vztaženy na mikroskopické ionizační konstanty disociujících skupin.
Aminokyseliny
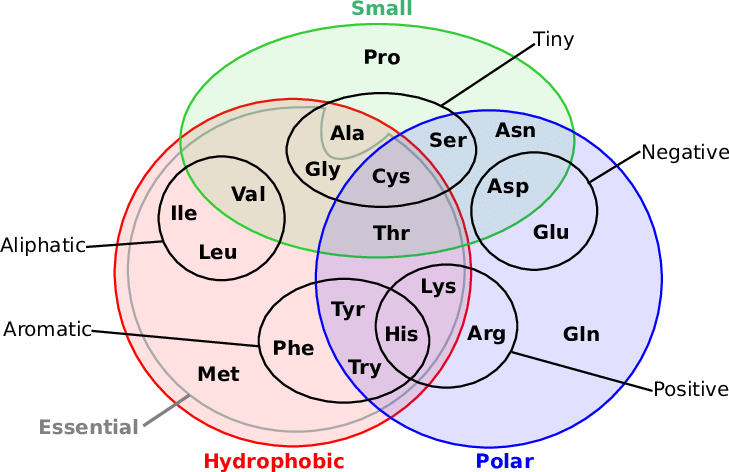
- náboj, titrační křivka (viz dále)
- velikost (viz obrázek níže)
- charakter skupin na R, zda jsou či nejsou aromatické
- pozn. prolin není aromatický, jeho cyklus ale významně ovlivňuje vlastnosti řetězce—je v daném místě méně pružný
- leucin, izoleucin, valin, jsou vybaveny větveným alifatickým řetězcem
- izobutylová skupina je chováním podobná alifatickému uhlovodíku \(\implies\) je hydrofobní
\(\ce{S-H}\) skupina v cysteinu bude oxidovaná či redukovaná v závislosti na prostředí, může tvořit\(\ce{S-S}\) můstky ať už s jiným cysteinem, nebo s jinými látkami- jeden konec lysinu se chová polárně, druhý ne
- aminoskupina má kolem pH 7 kladný náboj
- alifatický řetězec je hydrofobní
- optická aktivita
- všechny až na Gly jsou asymetrické
- Gly má na flexibilitu řetězce opačnou vlastnost než Pro, zvyšuje ji
Všechny tyto vlastnosti se různě kombinují a přispívají tak k celkovým vlastnostem dané AK.
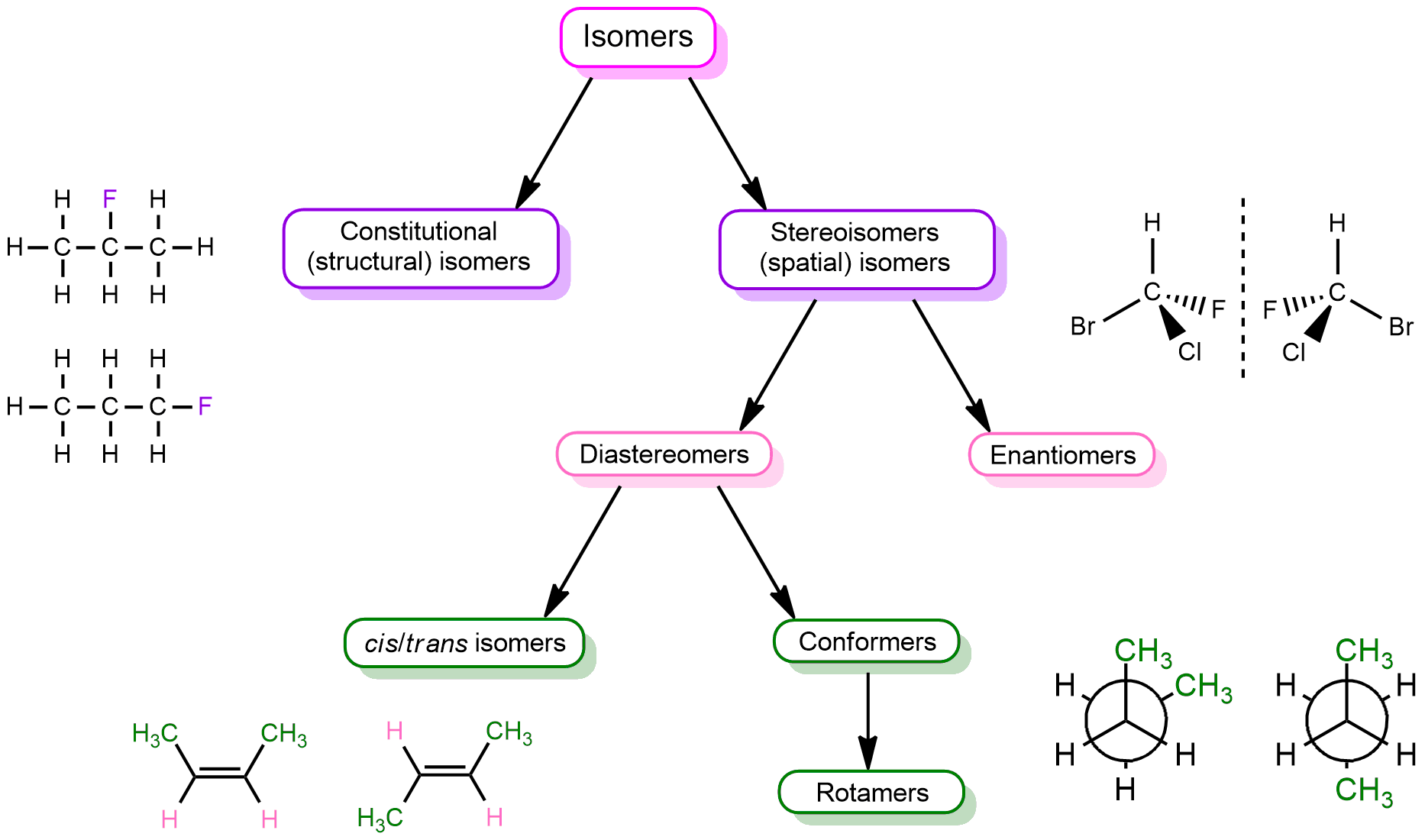
- AK tvoří stereoizomery, tzv. entantiomery, jsou svým zrcadlovým obrazem
- nejsou chemicky rozlišitelné, ale stáčejí rovninu polarizovaného světla na různé strany
- pozor, ne vždy L doleva a D doprava
- běžně se vyskytují L-formy
- jejich názvosloví se odvozuje od Fisherovy projekce u cukrů
- Thr a Ile mají více center asymetrie (více chirálních uhlíků)
- tvoří tzv. diastereomery (narozdíl od enantiomerů nejsou svým zrcadlovým obrazem)
- rozlišuje se pak například L-Thr a L-allo-Thr
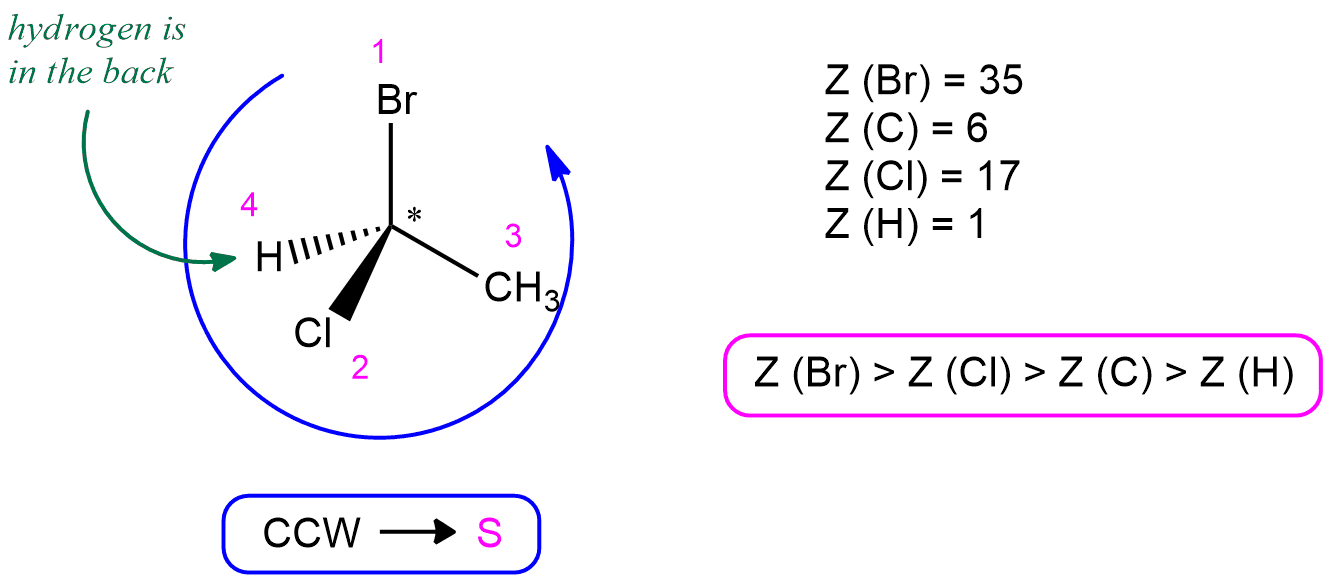
Existuje i jiný systém pojmenovávání stereoizomerů L a D, a to tzv. R/S systém (neboli Cahn-Ingold-Prelog).
- nakreslíme šipku od substituentu s nejvyšší prioritou k tomu s nejnižší prioritou
- priorita substituentů je určována podle velikosti skupiny
- vodík se umístí tak, aby byl za uhlíkem
- pokud jde šipka po směru hodinových ručiček, jedná se o R sloučeninu (rectus = pravý), jinak se jedná o S sloučeninu (sinister = levý)
- všechny AK v těle, s výjimkou cysteinu, jsou S-sloučeniny
- histamin: význam v alergických reakcích (nastane dekarboxylace histidinu, vznikne histamin)
- histidin získáváme z potravy, neumíme ho syntetizovat
- dopamin: prekurzor neurotransmiterů, regulačně aktivní látka
- kyselina γ-aminomáselná (vzniká dekarboxylací kyseliny glutamové)
- látky odvozeny jednoduchými reakcemi z AK (velmi důležité)
- některé AK, které se běžně v proteinech nevyskytují, jsou součástí nějaké metabolické dráhy
- např. citrulin (~ Arg) a ornitin (~ Lys) jsou součástí cyklu močoviny
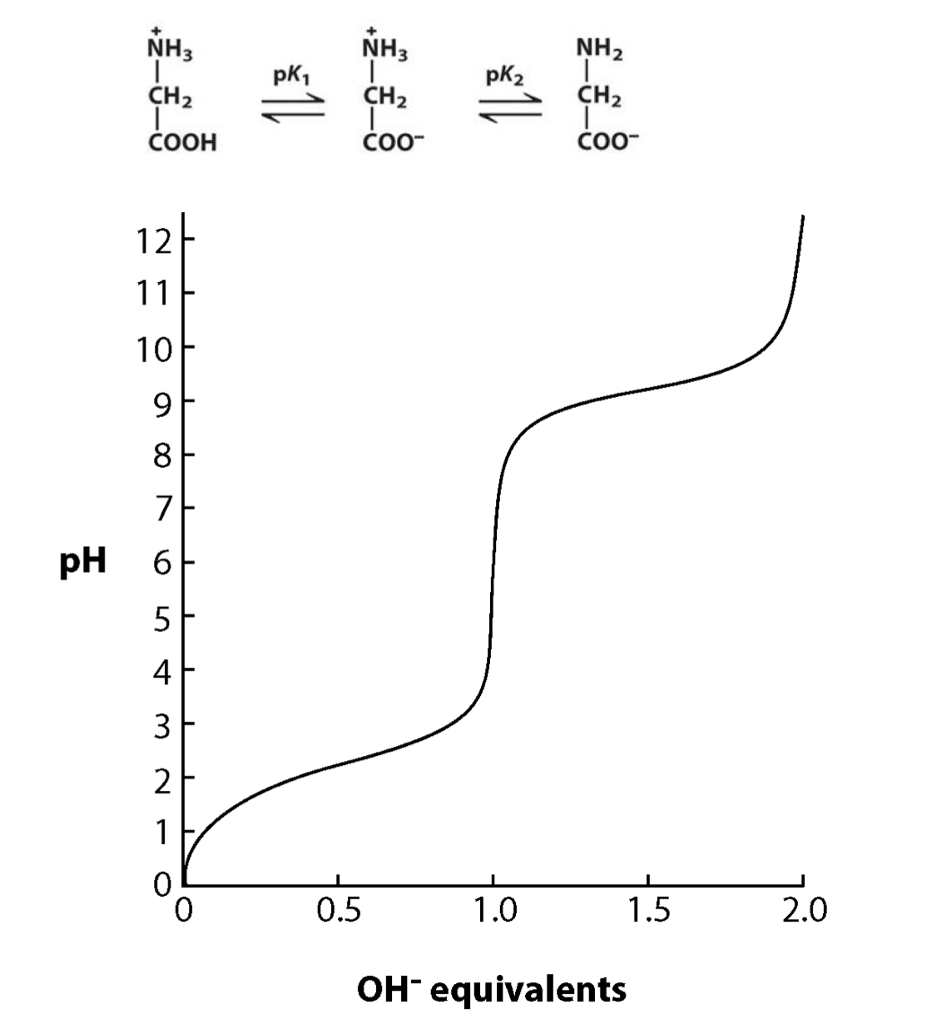
Acidobazické vlastnosti AK
Příklad disociační křivky na Gly.
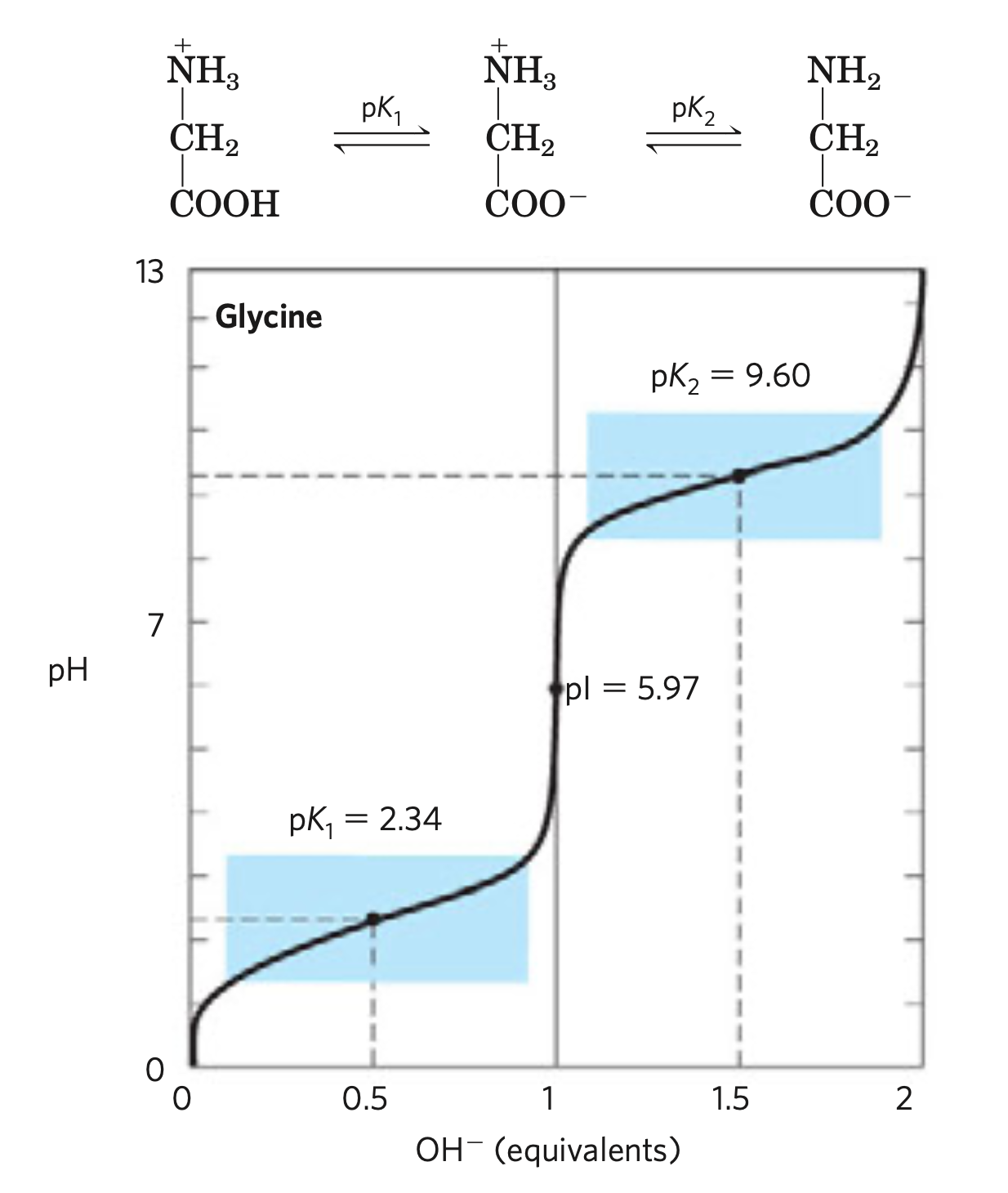
Tato křivka se týká volné AK–pro Gly vázaný v proteinu by takto nevypadala. Gly na C- nebo N- konci si však jednu skupinu zachová, což může hrát roli.
Jedná se o zjednodušený model toho, jak se chová látka s více disociovatelnými skupinami. Např. Lys se bude chovat mnohem složitěji, protože má tři acidobazické skupiny, které navíc nejsou dostatečný počet pH bodů od sebe, čili se ovlivňují.
- při velice nízkém pH je glycin plně protonovaný
- tvar křivky vychází z Hendersonovy-Hasselbachovy rovnice
- obě disociace jsou si velmi vzdálené \(\implies\) neovlivňují se
- v bodě PI, tzv. izoelektrický bod, má AK nulový náboj \(\implies\) nepochybuje se v elektrickém poli
- v bodech
\(pK_1\) a\(pK_2\) jsou už plně disociované skupiny\(\ce{COOH}\) a\(\ce{NH3}\) , respektive \(pK\) karboxylové skupiny je asi 2.2,\(pK\) aminoskupiny je asi 9.4
Protein se skládá z řádově stovek AK, bude proto mít velice složitou disociační křivku. Některé AK budou acidobazicky zajímavé pouze, když budou na konci proteinu; jiné budou zajímavé i jindy, a to při různých hodnotách pH (viz obrázek).
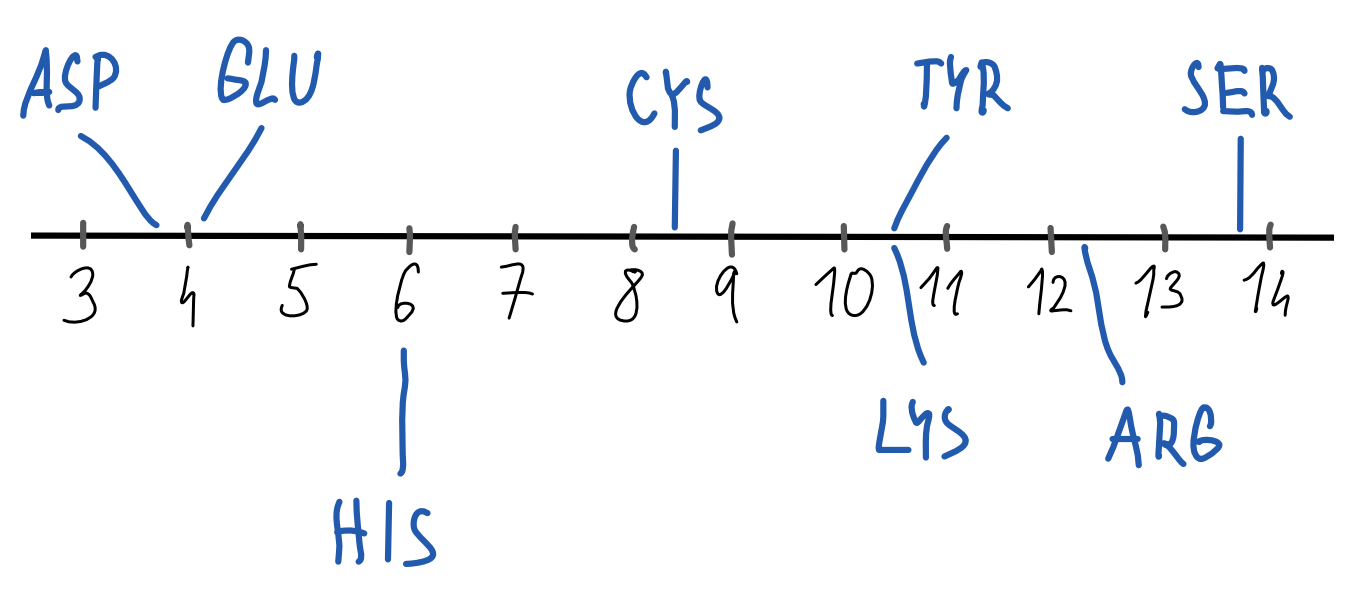
Jakmile se např. Asp dostane do pH7, bude ze větší části již naprosto disociovaná a nebude se již chovat jako kyselina. Obecně, pokud zvyšujeme pH (= zvyšujeme zásaditost prostředí), budou se skupiny zbavovat protonů—mění se ale to, jaký náboj tímto AK získají.
Důležitá je imidazolová skupina, která ma jako jediná
Posttranslační modifikace AK
- úpravy proteinu po translaci
- methylace: důležité na histonech
- fosforylace: zásadní regulační funkce
- serin, threonin, tyrosin
- acetylace: typicky Lys, vnik amidové vazby, která mění pH (při pH 7 pak už Lys nebude kladně nabitý)
- když Lys acetylujeme v jádře, ovlivňujeme interakce proteinů s NK (ty jsou totiž záporně nabité)
- karboxylace
Například kurděje jsou avitaminóza poškozující schopnost hydroxylace prolinu, který je potřeba pro pojivové tkáně: první projev je krvácení z dásní, způsobené problémy s extracelulární matrix.
Kovalentní struktura proteinů
Proteiny jsou tvořeny AK spojenými peptidickou vazbou, nebo
- cis, trans uspořádání
- vazby po prolinu i v cis, asi z 10%
- torzní úhly
\(\psi\) a\(\phi\) - rezonance ve vazbě, planarita
- pokud chceme planaritě zabránit, musíme udělat z rezonanční vazby vazbu jednoduchou (ovlivněním náboje, ovlivnění
\(\ce{C-O}\) )
- pokud chceme planaritě zabránit, musíme udělat z rezonanční vazby vazbu jednoduchou (ovlivněním náboje, ovlivnění
- rotace kolem
\(\text{C}\alpha\) - denaturace (ztráta pevné 3D struktury)
- primární, sekundární, terciární, kvarterní struktura
- fibrilární a globulární proteiny
- fibrilární jsou založené na neustálém opakování sekundárních struktur
- první analýzy se dělaly na fibrilárních proteinech, je to jednodušší
- tři druhy helixů
- paralelní a antiparalelní uspořádání β-řetězců
Všechny tyto pojmy lze nalézt popsány v odkazech výše.
\(\ce{NH}\) a\(\ce{CO}\) skupiny, které jsou součástí peptidové kostry, nejsou volné, ale jsou vůči sobě orientovány a interagují H-můstky- můstky budou téměř rovnoběžné s osou helixu
- všechny vnitřní skupiny jsou angažovány \(\implies\) stabilizace struktury
\(\ce{NH}\) a\(\ce{CO}\) skupiny na koncích nejsou součástí H-můstků a tak získáváme částečně nabitou strukturu, která má dipólový moment a podle toho se bude orientovat v el. poli\(\ce{NH}\) parciální kladný náboj,\(\ce{CO}\) parciální záporný
- R skupiny AK směřují vně helixu
- jedna rotace helixu je dlouhá ~3.6 AK \(\implies\) pokud např. každou 4. AK vybavíme hydrofobicitou, budeme tvořit válec, který bude z jedné strany hydrofobní
- a když máme dva takové, tak bude docházet k hydrofobním interakcím, přilnou k sobě
- uprostřed struktury není místo, nevejde se tam molekula rozpoštědla
- stabilita záleží na řetězcích R (např. dva kladně nabité R vedle sebe by mohly snižovat stabilitu helixu)
AK tedy můžeme rozdělit dle dalšího kritéria, kompatibility s helikální strukturou—dá se změřit např. tak, že z helixu odebíráme jednu AK po druhé a vždy změříme jeho stabilitu. Díky tomu lze poté z (části) primární struktury proteinu predikovat, zda zaujme tvar helixu, či nikoli.
Podobně se dají predikovat i jiné sekundární struktury, například levotočivý polyprolinový II helix, který se nachází v kolagenu a obecně všude tam, kde je mnoho Pro.
- R míří nad a pod řetězec, můžeme opět tvořit strukturu s různými vlastnostmi na dvou stranách
- většinou max 6 AK na 6 AK, někdy ale i větší (např. β-keratiny)
- β-α-beta
- β vlásenka
- α-α
- motiv řeckého klíče
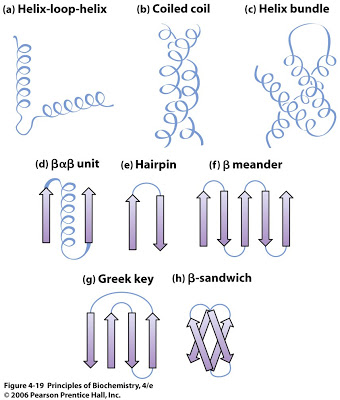
Kombinace sekundárních a supersekundárních struktur tvoří domény—útvary, které zaujmou stabilní konformaci i když jsou exprimovány odděleně od zbytku proteinu (= samostatné jednotky, co se foldu týče).
- α domény
- svazky čtyř helixů v cytochromu b562 u E. coli, lidský růstový hormon
- β domény
- β sendvič: imunoglobulinový motiv
- dva přeložené β-listy tvoří sendvič, stabilizace je dána tím,že vnitřní strana je hydrofobní
- β barel: retinol-vazebný proteinu
- pokud budeme β list stáčet jako papír, bude mít tendenci se zkrucovat, vytvoří soudek (β barel)
- může sloužit jako pór pro molekuly vody
- kombinace řeckých klíčů: bakteriální amidáza
- β-listy, které dělají částečně plošné struktury
- na okrajích listů se tvoří vazebná místa, aktivní centra
- β sendvič: imunoglobulinový motiv
- α-β domény
- α-β barel: součást trióza-fosfát-izomerázy
- jeden z nejstabilnějších proteinových tvarů v přírodě
- α-β barel: součást trióza-fosfát-izomerázy
Takovýchto struktur jsou řádově stovky (tj. relativně málo).
Síly udržující stabilitu proteinů
K pro rozrušení nativní konformace proteinu dlouhého ~100 AK je třeba dodat cca
Energie
Protein musí být po splnění své funkce snadno degradovatelný, aby z jeho částí mohl být syntetizován protein nový. Pokud se tak neděje, a v těle se objeví nějaká superstabilní struktura, bývá to často příčinou onemocnění (Alzheimer, prionové choroby, atd.).
- Solvatace
- Obalení rozpuštěné látky molekulami rozpouštědla.
- Chaotropní látky
Látky, které narušují nekovalentní vazby (jako např. H-můstky); u proteinů tedy přidáním chaotropního agens může dojít k denaturaci.
Chaotropní soli odstiňují náboje, zatímco jiné chaotropní látky (např. ethanol) samy interferují s nekovaletními vazbami.
- jsou sice silné, ale přispívají ke stabilitě proteinů relativně málo
- tvorba iontového páru není provázena velkým poklesem volné energie vzhledem k solvataci
- velmi málo iontových párů se nachází uvnitř proteinu
- iontové páry na povrchu proteinu nejsou konzervovány v evoluci
- přispívají ke stabilizaci proteinů jako takových relativně málo (kolem
\(2\) až\(8\) \(\pu{kJ/mol}\) ), ale jsou významné pro sekundární struktury - silnější jsou můstky v hydrofobním vnitřku proteinu
- většina vodíkových můstků se vytváří pouze mezi blízko se nacházejícími AK, jsou tedy pouze lokální
- 68 % můstků v proteinech se vytváří mezi atomy peptidové kostry, zbylé můstky jsou většinou mezi atomy vzdálenými max 5 AK
- neangažované můstky na koncích dodají struktuře parciální náboj, který může být dále využitý (např. k reakci s R skupinami či s okolím)
- ve sbalené struktuře ale bývají angažované (skoro) všechny donory i akceptory
- tvoří se spojením skupin cysteinu, jsou nekovalentní
- nejsou rozhodující pro zaujetí nativní konformace, ale jsou důležité
- jsou sice slabé, ale přispívají ke stabilitě proteinu významně
- přispívají rozhodujícím způsobem je stabilitě nativní konformace
Například sbalení hemoglobinu (globulární struktura) je zapříčiněno především hydrofobními interakcemi—uvnitř sbaleného proteinu skončí AK s hydrofobními skupinami, na povrchu AK polární. Kdybychom tuto strukturu narušili nějakým činidlem (např. 8M močovina), a pak jím přestali působit, opět se sbalí do původního tvaru.
- Hofmeisterova lyotropní řada
- Řada aniontů a kationtů, seřazená podle toho, jak velká koncentrace daného iontu je potřeba k vysrážení vaječného bílku (tedy podle snižujícího se molárního povrchového napětí).
Protein folding
- Levinthalův paradox
- Pokud bychom měli protein se 100 AK, pro každý torzní úhel uvažovali pouze 3 hodnoty a každou sekundu vyzkoušeli
\(10^{13}\) různých možností, potřebovali bychom k vyzkoušení všech prostorových konfigurací našho proteinu\(10^{87}\) sekund (což je asi\(\pu{2e69}\) -krát více než je předpokládáné stáří vesmíru, pozn. redaktora).
Jak se zdá z Levinthalova paradoxu, dělá to příroda nějak jinak.
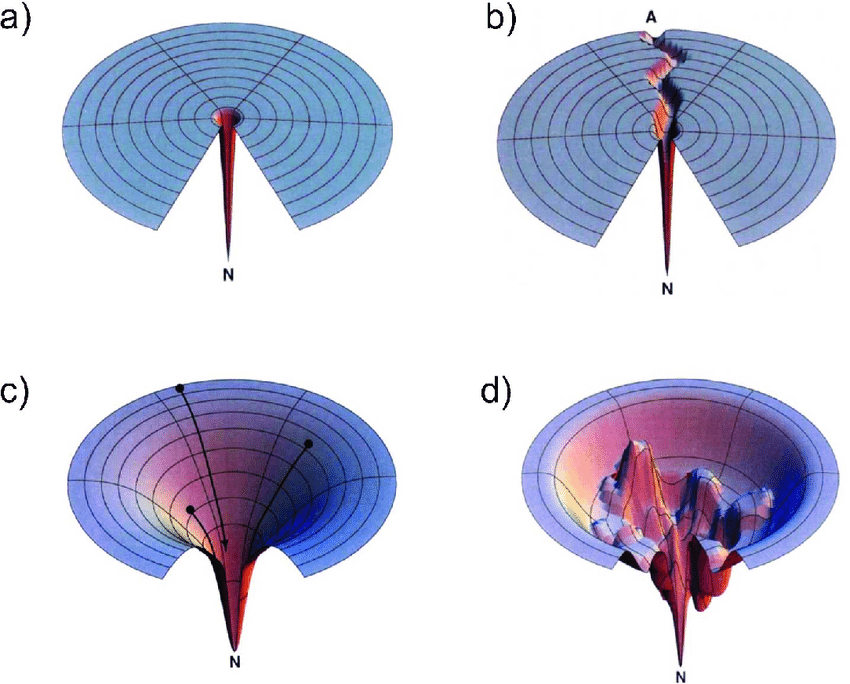
- obr. a) popisuje představu z Levinthalova paradoxu (musíme se po ploše náhodně pohybovat, dokud nenalezneme bod N)
- obr. b) popisuje starou a překonanou představu, že se proteiny foldují po cestě mezistavů
- obr. d) popisuje současnou představu: proteiny hledají stav energetického minima (obrázek představuje hladinu volné energie)
- po odstranění denaturačního činidla proteiny v řádu ms zaujmou tvar, který pak připomíná nativní konformaci
- nastává rychlý hydrofobní kolaps
- pak následuje několik vteřin, kdy se to sesypává, stabilizuje, dochází ke drobným úpravám
- až po desítkách vteřin či minutách dostáváme finální konformaci
- celková struktura je podmíněná částečnými, například sekundárními, strukturami (folding probíhá hierarchicky)
- lokální úsek má svou autonomii, nehledě na okolí se (zpravidla, s vyjímkami) poskládá do své jedné sekundární struktury
- potažmo tedy lokální složení AK rozhoduje o vzniku vyšších struktur
Někdy se může protein dostat do “pasti” (je nutné překonat stav s vyšší energií, než se bude možné dostat ke globálnímu minimu)—tu mu mohou pomoci překonat chaperony.
- α-keratin je příkladem superhelixu
- helixy se skládají do dimerů, ty do protofilament a ty do mikrofibril
- na obrátku je ve dvojitém helixu pouze 5.1, na rozdíl od 5.4 v α-helixu
- každá 4. a 6. (tj. poslední na otáčku) AK je hydrofobní a dva helixy se tak zazipují do dimeru (hydrofobními AK k sobě)
- pružnost keratinu klesá s rostoucím množstvím příčných disulfidových vazeb mezi protofibrilami
- helixy se skládají do dimerů, ty do protofilament a ty do mikrofibril
- fibroin je příkladem β skládaného listu, je to složka např. hedvábí nebo pavučin
- v β-strukturách se střídají vrstvy postranních řetězců glycinu s řetězci alaninu a serinu
- kolagen, složka např. chrupavek, je příkladem trojitého helixu
- každým třetím zbytkem jeho polypeptidu je glycin, obsahuje ale také relativně mnoho prolinu a hydroxyprolinu
- vytváří strukturu podobnou lanu, která je velice pevná v tahu
- molekuly kolagenu agregují v posunutém (střídavém) uspořádání a vytvářejí fibrily, které jsou kovalentně příčně spojeny skupinami, odvozenými od postranních řetězců histidinu a lysinu
- prolyl-hydroxyláza vyžaduje jako kofaktor vitamin C
- elastin, jak napovídá jeho název, má elastické vlastnosti a tvoří prostorovou síť vláken s nepravidelnou strukturou
- jeho polypeptidová vlákna jsou spojena podobným způsobem jako u kolagenu.
Struktura a funkce globinů
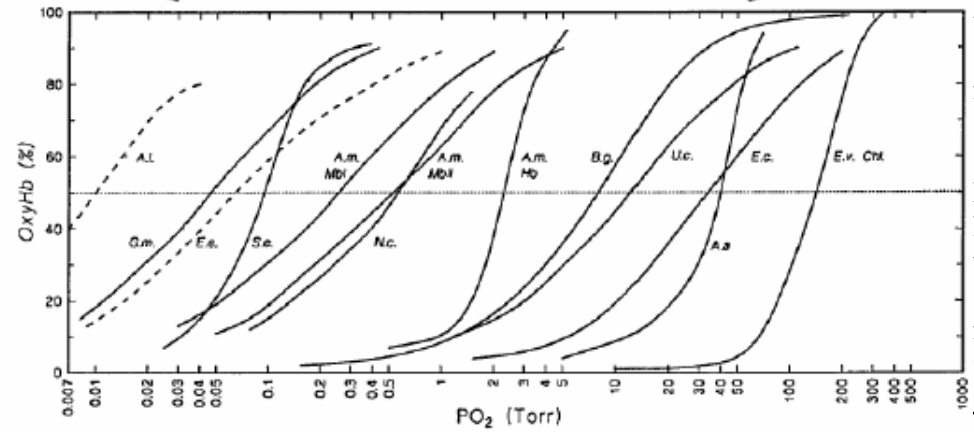
- organismy žijí v různých parciálních tlacích kyslíku
- kyslík je vázaný s různou afinitou
- křivky (vynesené pro různé organismy) mají sigmoidní tvar (viz obrázek): daný organismus má přenašeč, který v nízkých koncentracích nebude vázat nic, a až ve vyšších všechno
- systém je nastaven tak, že funguje v určitém rozmezí kyslíku a právě v tom jej umí vázat či uvolnit
- tato vlastnost je dána tím, že se jedná o oligomerní molekuly, které jsou schopny spolu kooperovat
- v jiném případě by se mohlo stát, že organismus sice bude vázat kyslík, ale nebude schopen jej v tkáních uvolňovat
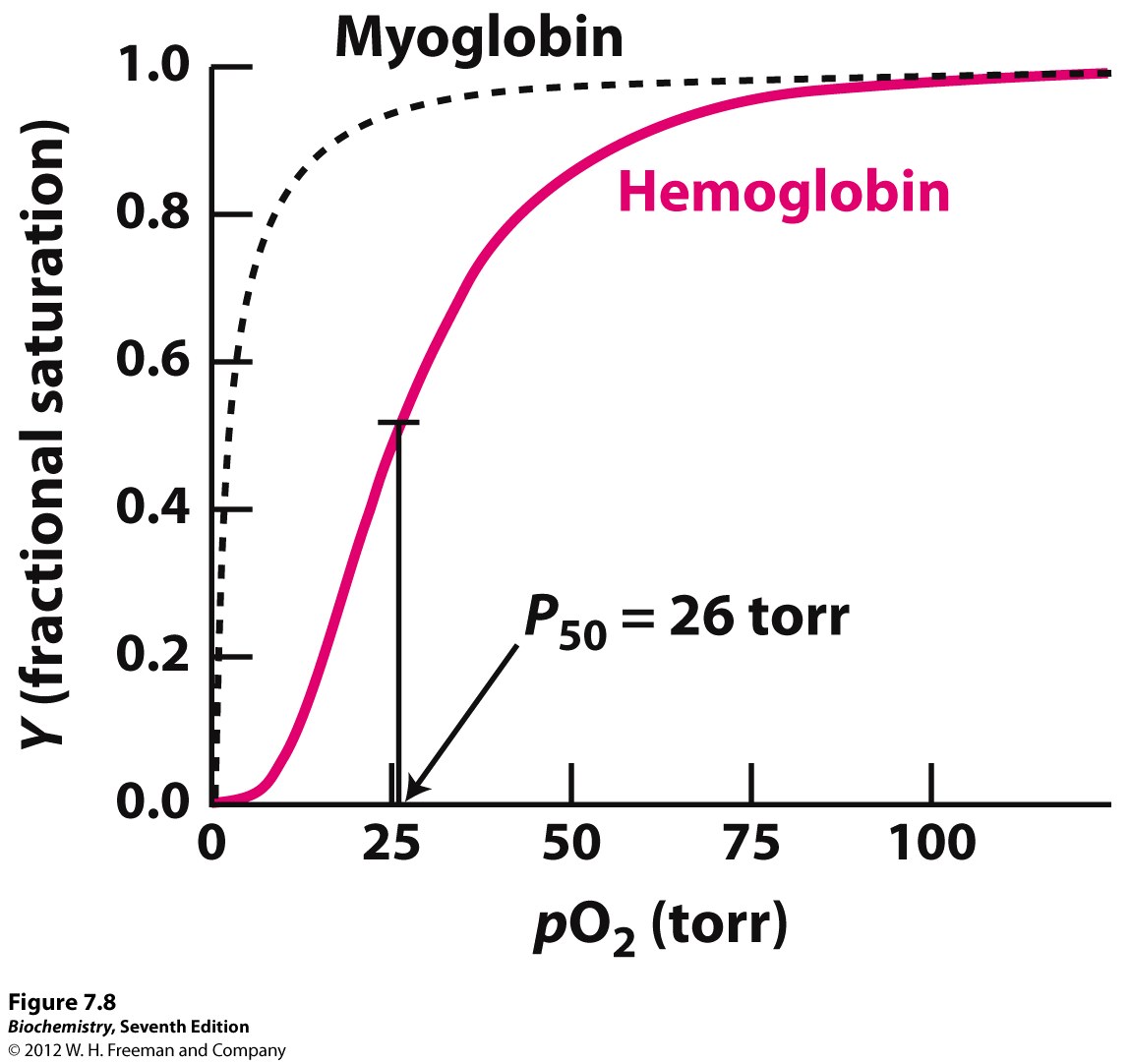
- Saturační křivka
- Na ose
\(x\) je tlak\(\ce{O2}\) v torrech, na ose\(y\) je saturace\(\ce{O2}\) v procentech.\(p50\) je parciální tlak, při kterém jsou přenašeče saturovány z 50%. - Hemerythrin
- Obdoba hemoglobinu, je také vícepodjednotkovým komplexem. Mají ho hlavatci, ramenonožci.
- Hemocyanin
- Má jej třeba ostrorep, také existuje jako oligomer.
- Myoglobin
- Monomer, není tedy schopen zajistit kooperativní sigmoidní chování. Saturační křivka má tvar hyperboly (viz obrázek).
Hemoglobin
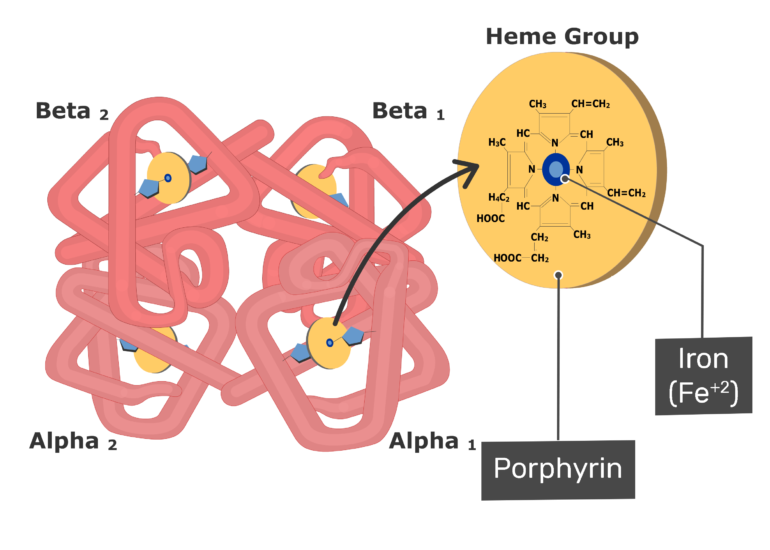
- tetramer se dvěma α a dvěma β podjednotkami, každá z nich má konjugovaný heterocyklický systém s
\(\ce{Fe^2+}\) (HEM), hemoglobin tedy jejich prostřednictvím umí vázat 4 molekuly kyslíku - po vazbě kyslíku se mění kvartérní struktura
- např. u konce molekuly jedné podjednotky vůči druhému konci jiné
- dále se mění i díra uprostřed (oxygenací se zmenší)
- dochází k natočení dvou podjednotek vůči ostatním
Ve interakci podjenotek spočívá sigmoidní chování.
- podjednotky jsou nekovalentně spojené, ale přesto se významně ovlivňují
- máme-li situaci bez kyslíku, přicházejí molekuly postupně (1., 2., 3. 4.)
- vazba první molekuly pozitivně ovlivní vazbu těch dalších \(\implies\) když už je tam jedna, ostatní se váží snáz
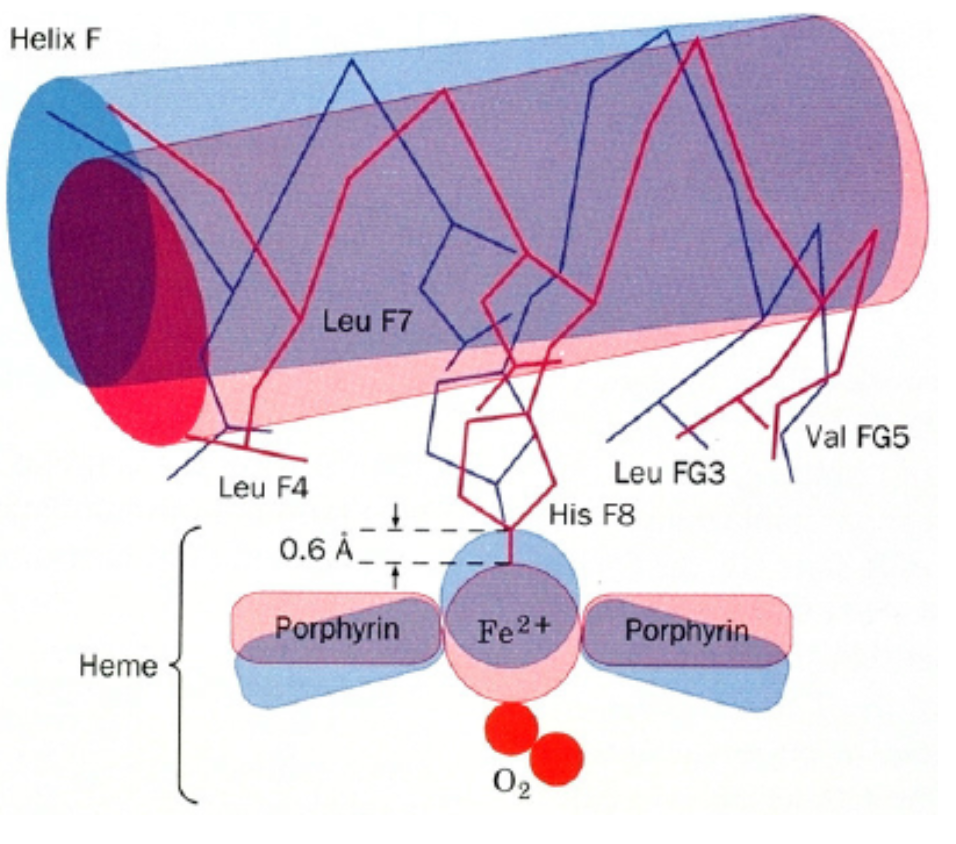
- v deoxygenovaném stavu (= T, tense) je molekula porfyrinu deformována, není rovinná \(\implies\) vázaný hem je umístěn v dutině (kavitě)
- to má za následek řadu dalších změn, ke kterým v rámci podjednotky dochází
- má tzv. domovou strukturu, kyslík se setkává s nižší afinitou, než kdyby byl hem “vystrčený”
- je to způsobeno vazbami u železa, které jsou bez vázaného kyslíku delší a vytvoří onu proláklinu
- po vazbě kyslíku (= R, relaxed) se porfyrin narovná a přes blízký histidin (proximální histidin) přesune část pohybu i na helix F (viz obrázek), ten přesune pohyb i na zbývající podjednotky v molekule
- struktura funguje jako mechanický převodník
- hem se trochu vystrčí a má vyšší afinitu ke kyslíku
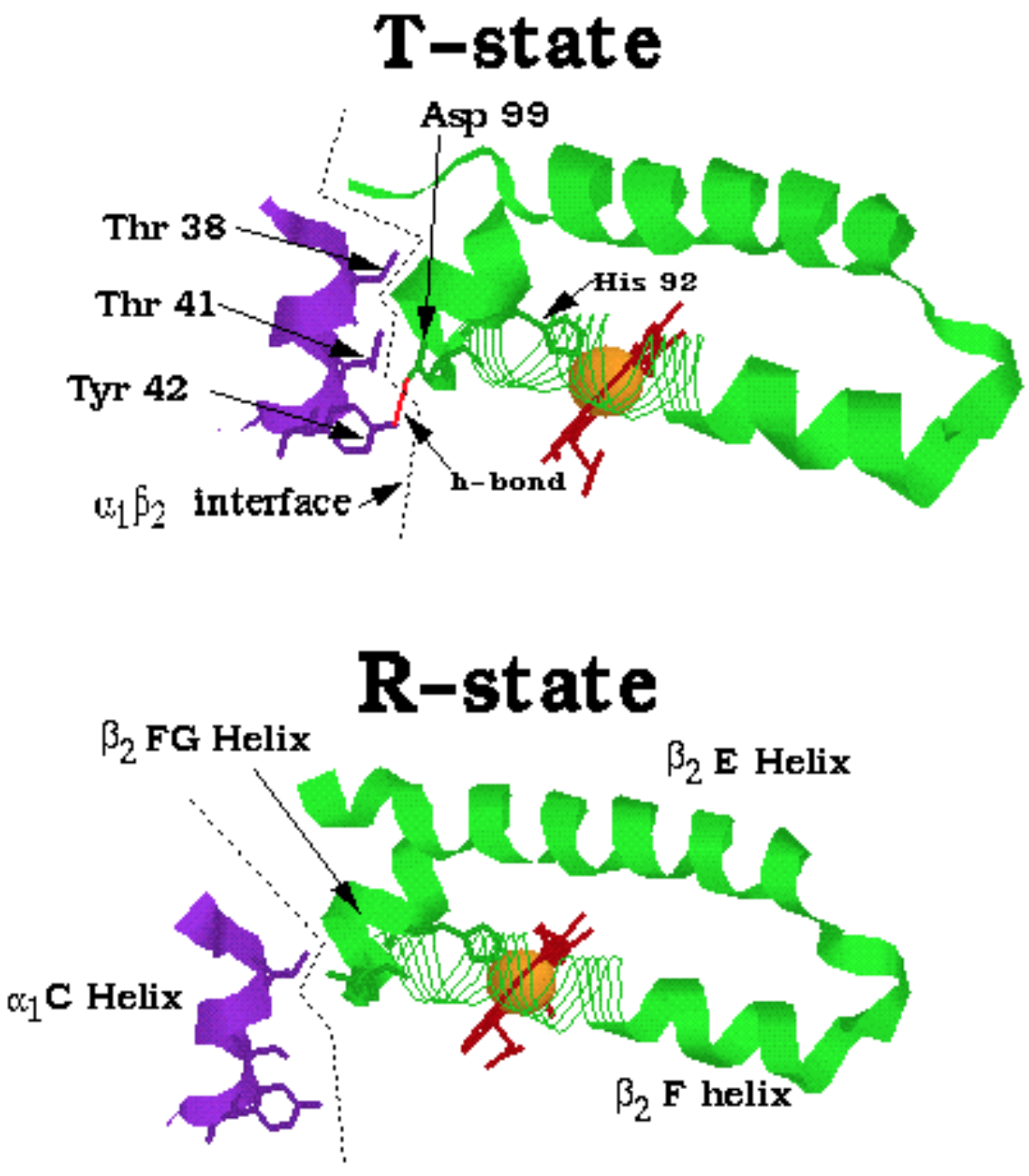
- α1 + β1: 35 AK kontaktů
- α1 + β2: 19 AK
- α1 + α2: vlastně žádný
- analogicky pro α2
Podjetnotky α1 + β1 jsou tedy téměř nepohyblivě spojené, struktura se tedy dá vnímat jako dva dimery spíše než čtyři monomery. Mezi těmito dvěma podjednotkami bude docházet k pohybům, při oxygenaci se vůči sobě otočí o 15 °. Také se změní pozice tyrosinu z C helixu vůči histidinu, viz obrázek.
Sigmoidní tvar je tedy způsoben tím, že první kyslík se váže relativně složitě (hem je zastrčený), po jeho navázání ale vnutí daná podjednotka rovnější tvar porfyrinu i ostatním podjednotkám a další kyslíky se už váží čím dál snadněji. Po nasycení hemoglobinu se saturační křivka opět vyrovná. Kdybychom měli oligomer s více než čtyřmi podjednotkami, mohl by se chovat ještě více kooperativně a mít ještě prudší křivku.
Pokud bychom oslabili nějaká spojení, získali bychom plošší křivku, oslabilo se kooperativní chování (jednotky by se tak neovlivňovaly). Pokud by se naopak posílily vazby, dlouho by se nic nevázalo, dokud by parciální tlak nevzrostl až do určité hodnoty—první navázání kyslíku by mělo před sebou více práce; čím pevnější vazby mezi podjednotkami budou, tím se bude celek chovat kooperativněji, stylem všechno nebo nic.
- Homotropní efekt
- Druh alosterického efektu, při kterém látky ovlivňují afinitu molekuly k sobě samé (jako např. zde s kyslíkem, kdy kyslík usnadňuje vázání kyslíku). Rozděluje se na pozitivní a negativní (kyslík je příkladem toho pozitivního). Opakem by byl heterotropní efekt.
Hemoglobin tedy umožňuje při určité koncentraci kyslík vázat a při jiné uvolňovat. Tuto jeho vlastnost je ale možné dále regulovat.
- slouží k přizpůsobení změnám v koncentraci kyslíku v prostředí
- dá se vypozorovat například ze saturačních křivek v 0 m.n.m. a 4500 m.n.m.
- běžně je v kapilárách tlak as 25 torrů, v plicích (a v prostředí) 100: při 100 saturujeme, při 25 desaturujeme
- ve 4500 m.n.m.: tlak je asi 50, pracovali bychom tedy s nižší kapacitou, musíme snížit afinitu ke kyslíku
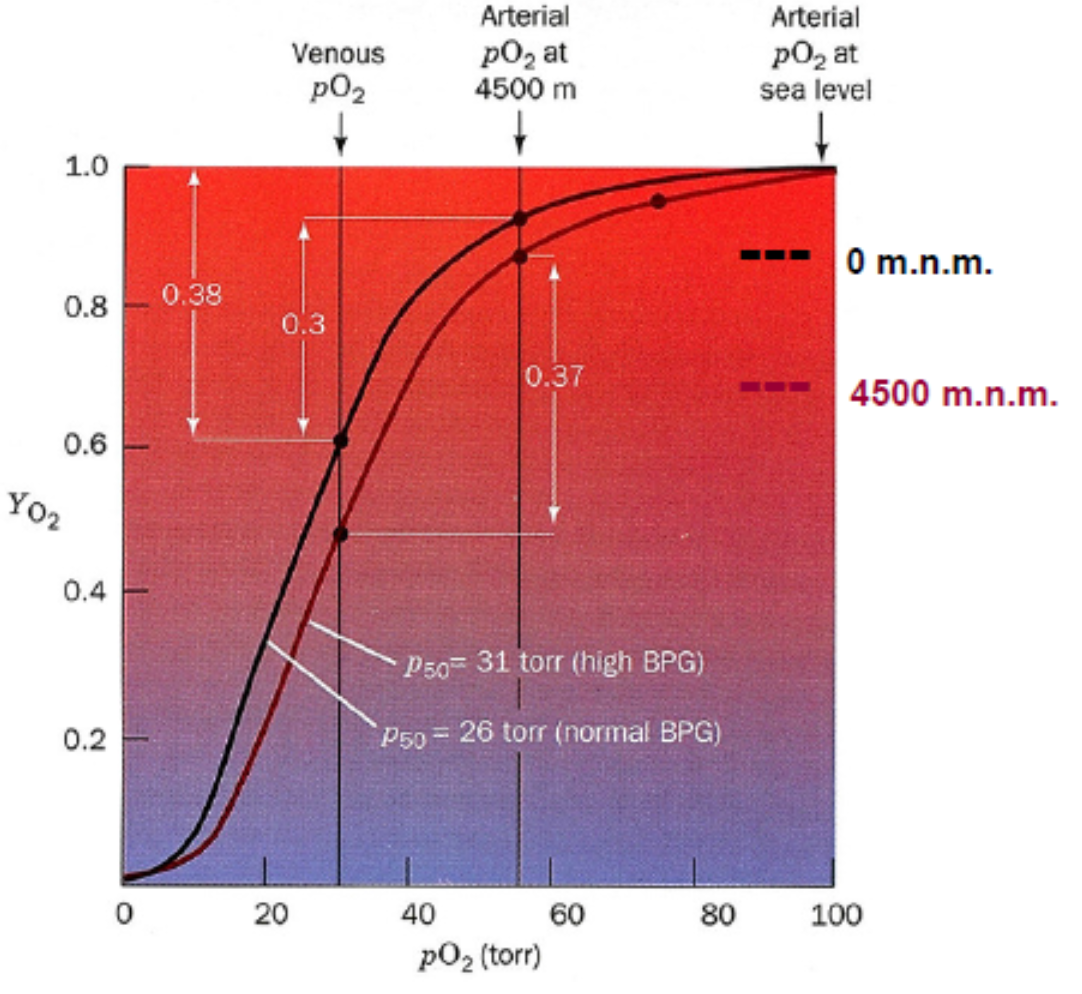
O tyto změny se stará kyselina bisfosfoglycerová.
- odvoditelná z glykolýzy, v erytrocytech se jí dají tvořit různé koncentrace
- váže se na pozitivně nabité zbytky (má fosfátové skupiny a karboxyskupiny)
- váže se do dutiny v hemoglobinu, a váže se tam silnou vazbou, pokud je dutina dostatečně velká, aby se uplatnily všechny interakce s kyselinou––a to je pouze v deoxygenovaném stavu
- 2,3-BPG po vazbě posouvá rovnováhu oxy-deoxy k deoxy stavu
- skrze BPG tedy máme schopnost změnou koncentrace jedné látky ovlivnit afinitu pro kyslík
- podobně i změna pH vede k posunu afinity pro kyslík (opět prostřednictvím BPG)––pohybujeme-li se ke kyselejšímu, snižujeme afinitu ke kyslíku
V souvislosti s oxy a deoxy hemoglobinem můžeme psát rovnici
kde se
- BPG
- ta funguje těmto způsobem např. u savců, u ptáků máme jinou, všeobecně to bývají nějaké nabité sloučeniny
- protony (potažmo pH)
- v plicích bude vyšší pH, méně
\(\ce{CO2}\) , méně uhličitanu, méně chloridových iontů \(\implies\) hemoglobin naloží hodně nákladu a putuje do kapilár - svalová námaha vede k okyselení a poklesu pH, což sníží afinitu pro kyslík \(\implies\) ve svalech se vyloží ještě více kyslíku
- v plicích bude vyšší pH, méně
\(\ce{CO2}\) - při dýchání vzniká v tkáních, snižuje tam afinitu hemoglobinu ke kyslíku a hemoglobin tak vyloží víc kyslíku, než kdyby tam nebyl
\(\ce{Cl-}\) - do erytrocytů se dostává v souvislosti s rozpouštěním
\(\ce{CO2}\)
- do erytrocytů se dostává v souvislosti s rozpouštěním
Celý orchestr je zorganizován tak, aby se využila maximální transportní kapacita. Efekt ovlivnění desaturace Hb pomocí pH a
- usnadňuje transport kyslíku
- deoxyHb je zásaditější než nasycený Hb
- změna konformace proteinu mění bodové pK’ o několik procent
- způsoben tím, že se k imidazolu přiblíží záporný náboj, čímž stabilizujeme výskyt kladného náboje na něm (jeho protonovanou formu)
- posouváme pK’ imidazolu
- jen přiblížením-oddálením (aspartát-imidazol, v tomto případě) měníme acidobazické vlastnosti, schopnosti vázat a uvolňovat protony v daném pH
- disociovatelné skupiny ovlivňují okolí
- v pH 6.5, což je pK’ imidazolu, by ho byla protonována cca polovina, ale je-li tam přiblížený aspatát, tak je protonována větší část
Bohrův efekt je vlastně v principu analogický k působení bifosfoglycerové kyseliny, chloridových iontů a podobně.
BPG nemění strmost křivky, pouze ji celou posouvá doprava (měníme p50). Strmost křivky se mění pouze změnou proteinu samotného, protože je závislá na míře kooperativního chování. Je sice jednoduché udělat křivku méně strmou (např. denaturací), ovšem opaku je relativně složité dosáhnout.
Modely alosterie
Popisujeme v nich chování hemoglobinu jako modelu, obdobně se budou chovat i další systémy, saturace se dá nafitovat. Dnes se již používají pokročilé postupy, zde jsou uvedené dva historické.
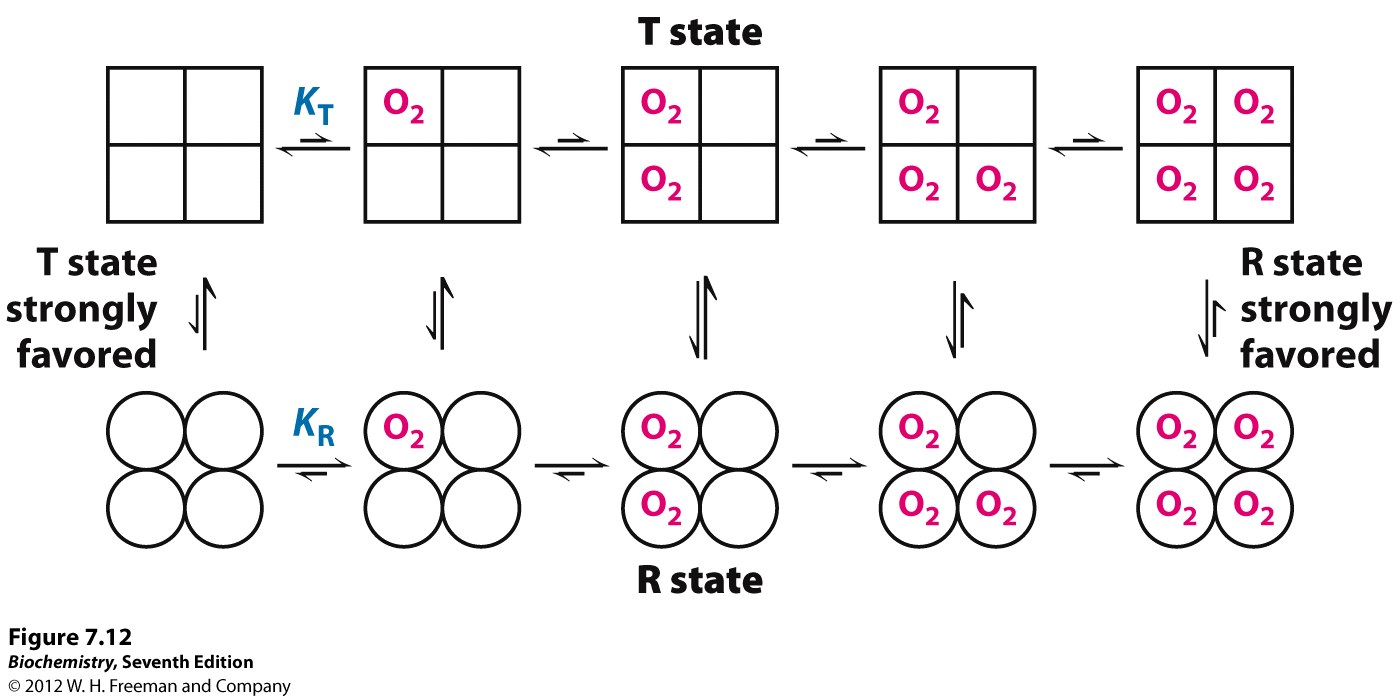
- vychází z představy, že hemoglobin je symetrický oligomer identických protomerů
- každý protomer může existovat ve stavech T (tensed) a R (relaxed), které mají nízkou a vysokou afinitu ke kyslíku, respektive
- změna stavů protomerů se děje pouze konformační změnou, a to u všech protomerů najednou (aby zůstala zachována symetrie)
- vychází z konceptu zámku a klíče
- vazba kyslíku je možná jen do aktivního centra s danými vlastnostmi
- ligand je klíč, zámek je molekula (místo, kam se kyslík váže)
- vazbou se posouvá koncentrace směrem z T do R
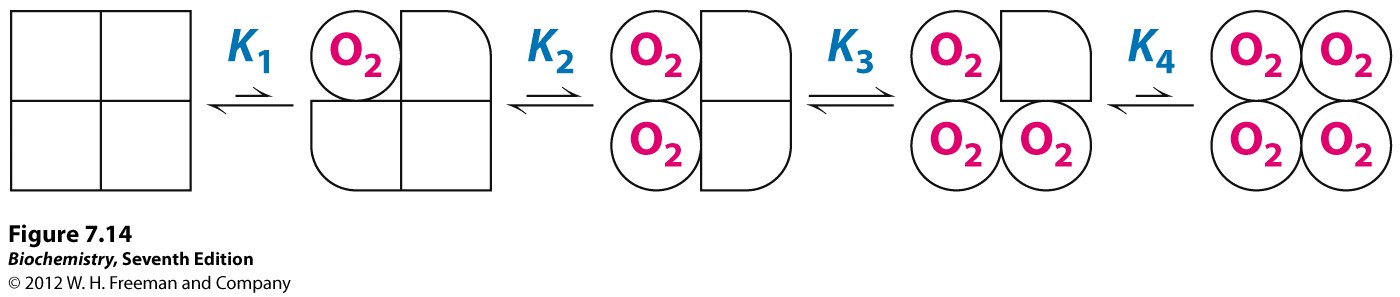
- používá koncept indukovaného přizpůsobení, oligomer nezachovává symetrii
- vazba ligandu na jeden protmer vyvolá konformační změnu, která ovlivní sousední protomery
- síla kooperativních interakcí je závislá na typu spojení podjednotek
- na počátku jsou všechny ve stavu T
- afinita protomeru pro vazbu ligandu se mění s množstvím ligandu navázaného v oligomeru
- není to vše nebo nic
- vazba ligandu vede k částečné změně, tzv. induced fit
- tento model proto více odpovídá realitě
Enzymy a enzymová kinetika
- Enzymy
Buněčné katalyzátory, proteiny s katalytickými schopnostmi. Katalyzátory jsou látky urychlující chemické reakce, aniž by do nich přímo vstupovaly–ovlivňují reakci, ale samy se chemicky nemění.
Thomas R. Cech, objevil to, čemu se dnes říká ribozymy, což jsou proteiny
- Katabolické dráhy
- Metabolické dráhy, které rozkládají složité látky na jednodušší za vzniku energie. Opakem jsou dráhy anabolické.
- Jönz Jacob Berzelius
- jako první použil pojem enzym a vyslovil teorii, že reakce v živých organismech neprobíhají neasistovaně, že existují nějaké molekuly, které se na reakcích podílí a urychlují je
- byl to chemik
- L. Pasteur
- popsal, že v buňkách je něco navíc, co způsobuje např. kvašení (pozoroval kvasinky)
- byl to vitalista; věřil tomu, že živé organismy mají v sobě něco nehmatatelného, vis vitalis, a dokazoval to tak, že když kvasinky zabil povařením, tak už glykolýzu neprováděly
- Eduard Büchner
- vyvrátil kocept vis vitalis, zabil kvasinky jinak než povařením (rozdrtil je, vytvořil tím bezbuněčné lyzáty, a enzymy stále fungovaly)
- Emil Fischer
- pracoval na cukrech; cukry mají spoustu izomerů, které se jen mírně liší strukturou, ale přesto jen některé z nich jsou katalyzovány enzymy
- přišel s teorií zámku a klíče, která tvrdí, že enzym má vazebné místo, které tvarově odpovídá molekule substrátu a to tak dokonale, že většina enzymů může katalyzovat jen jeden substrát
- Maud Leonora Mentenová
- kanadská badatelka, pracovala v Německu, věnovala se enzymové kinetice
- James B. Sumner
- jako první izoloval čistý enzym, ureázu
- ureáza je protein, který rozkládá močovinu
- dokázal, že enzymy jsou proteiny
- jako první izoloval čistý enzym, ureázu
Enzymy urychlují reakce, jsou tedy nezbytné pro život—například energie z cukru by bez nich nešla vydolovat, protože cukr se sám o sobě prostě nerozloží a energii neuvolní.
- pro reakce stačí mírnější podmínky
- oproti anorganickým katalyzátorům, které potřebují extrémní teploty, tlaky, pH
- většina dalších organismů žije a má teplotní optimum v normálním tlaku, neutrálním pH a teplotě 30–40°
- vyšší specificita reakce
- enzymy se málokdy pletou, pracují jen se svým substrátem a to ještě k tomu velice rychle
- např. proteosyntáza umí syntetizovat dlouhý řetězec bez chyby, naproti tomu u anorganické syntézy je pouze 30–40 AK nasyntetizováno neomylně
- schopnost regulace
- anorganické katalyzátory někam nasypeme a tam dělají to, čeho jsou schopny, zatímco enzymy mohou být regulovány
- regulace rychlosti je velice důležitá pro spolupráci katabolických drah s anabolickými
Stavba enzymů
- Koenzym
- Neproteinová část enzymu; ne všechny enzymy ji však mají.
- Apoenzym
- Proteinová část enzymu.
Koenzymů je celá řada.
- nabité molekuly, které se podílí na struktuře holoenzymu
- měďnaté ionty
- důležitým enzymem je cytochrom oxidáza, je členem elektrontransportního řetězce uvnitř mitochondrie (dále jen mch), který se stará o přenos elektronů a tvorbu ATP
- cytochrom oxidáza je posledním enzymem této dráhy, kde se kyslík redukuje na vodu—měďnaté ionty slouží jako akceptory elektronů, které jsou v rámci této dráhy přenášeny
- železité ionty
- opět cytochrom oxidáza, fungují úplně stejně jako ty měďnaté
- hemoglobin
- draslík
- pyruvát kináza, důležitý enzym glykolýzy
- hořečnaté ionty
- většina enzymů, které pracují s ATP, obsahují hořečnaté ionty, protože jejich náboje interagují s fosfátovými skupinami ATP
- zinek
- alkohol dehydrogenáza, důležitý enzym sloužící k syntéze nebo k odbourávání ethanolu
- karbonát anhydráza, enzym důležitý pro přenos oxidu uhličitého v organismu při dýchání
- větší molekuly, hlavně ze skupiny B
- několikero druhů
- molekuly pevně vázané na povrch enzymu
- molekuly, které se mohou oddisociovat (fungují jako jeden ze substrátů enzymu)
Druhý zmíněný druh poté může sloužit k různým účelům:
- mohou akceptovat nějakou funkční skupinu, pak se zase odpojit a přenést ji dále
- podílejí se na karboxylacích (přenáší karboxylovou skupinu z jedné části enzymu na jinou, slouží jako takové pohyblivé raménko)
- důležité jsou koenzymy flavin adenin dinukleotid (FAD), který přenáší elektrony, a nikotinamid adenin dinukleotid (NAD), který přenáší hydridové ionty
Názvosloví enzymů
Jméno enzymu vždy končí na “—áza”. Kromě toho má každý enzym přidělený kód Evropskou enzymovou komisí: ECXXXX, kde X značí číslo a EC je zkratka pro Enzyme Commision.
První číslo je vždy v rozmezí 1–6, protože se jedná o rozdělení enzymu do jedné z následujících kategorií, podle toho, jaký druh reakce katalyzuje:
- oxido-reduktázy: katalyzují reakce, při kterých se přenáší redukční ekvivalenty, směr přenosu je řízen redoxním potenciálem
- dehydrogenázy, peroxidázy, reduktázy... (biologické oxidace často probíhají jako dehydrogenace)
- transferázy: enzymy, které přenáší nějakou funkční skupinu z jedné molekuly na druhou
- typické jsou fosfo-transferázy, které přenáší fosfátovou skupinu z ATP na nějakou jinou molekulu
- např. v glykolýze, první glykolytický enzym přenáší fosfát na glukózu a tvoří se glukóza-6-fosfát
- typické jsou fosfo-transferázy, které přenáší fosfátovou skupinu z ATP na nějakou jinou molekulu
- hydrolázy: za adice vody štěpí nějakou molekulu na dvě
- lyázy: enzymy, které provádí syntézu molekuly ze dvou molekul
- izomerázy: provádí přestavbu nějaké molekuly
- ligázy: lepí molekuly dohromady, za současného odštěpení nějaké malé molekuly
- např. spojování Okazakiho fragmentů
Pokud máme například následující reakci:
Jedná se o první reakci glykolýzy; glukóza, která vstoupila do buňky, je fosforylována. Význam této reakce je dvojí:
- energizace cukerné molekuly
- strukturní změna, která zabrání tomu, aby se glukóza dostala zase ven z buňky (dostává se tam pomocí přenašeče, který je univerzální na obě strany)
Enzym by se dal nazvat ATP:glukózo fosfotransferáza (přenáší fosfát z ATP na glukózu). Pro zjednodušení by byl také možný název glukokináza (kinázy jsou enzymy, které něco fosforylují). A jak bychom tento enzym očíslovali?
[2], patří mezi transferázy, tedy do druhé enzymové třídy[7], přenáší fosfát[1], ...na hydroxylovou skupinu glukózy[2], cílová skupina se nachází na glukóze
Jedná se tedy o protein E.C. 2.7.1.2. Podobný enzym, hexokináza E.C. 2.7.1.1, je schopen fosforylovat i jiné hexózy (proto ta jednička na konci).
Enzym E.C. 1.1.1.1 je
- oxido-reduktáza
- působí na
\(\ce{CHOH}\) skupinu donoru - využívá NAD
- donorem
\(\ce{CHOH}\) skupiny je ethanol
Je to tedy akoholdehydrogenáza.
Regulace enzymatické aktivity
Probíhá buďto změnou kvantity samotného enzymu (musí nastat aktivace proteosyntézy toho enzymu, změna exprese apod.), nebo regulací samotného enzymu—to je mnohem rychlejší.
- regulace změnou dostupnosti reaktantu
- netýká se to přímo regulace aktivity enzymu, ale pokud nedodáme substrát, nemůže reakce běžet
- např. glykolýza
- alosterická regulace
- alosterické enzymy jsou takové, jejichž aktivita je regulována navázáním molekuly, jiné, než samotného substrátu
- regulace kovalentními modifikacemi
- např. pomocí protein-kinázy (adenylát-cykláza aktivuje protein-kinázu A a ta zase fosforyluje něco jiného)
- opět dochází ke změnám konformace
- regulace prostřednictvím regulačních proteinů
- regulace proteolýzou, ovlivněním konformace, změnou lokalizace
- regulace zastoupením izoenzymů
- izoenzymy jsou různé proteiny se stejnou funkcí, které katalyzují stejnou reakci, i když nejsou chemicky totožné
- nejčastější typ enzymové regulace
- existují alosterické aktivátory i inhibitory
- např. enzym na počátku metabolické dráhy může být alostericky inhibován produktem té stejné dráhy, naopak aktivátorem může být ATP
- časté řízení metabolické dráhy
- produkt se váže na alosterické místo a tím snižuje aktivitu enzymu (negativní zpětná vazba)
- je-li ho v buňce hodně (a málo produktu dráhy), tak se ATP váže na jiné alosterické místo a tvorbu produktu zrychluje
- funguje na základě změny konformace enzymu, který má poté k substrátu jinou afinitu
- některé enzymy se syntetizují v buňce v ER jako tzv. preenzymy: tvoří je jedno vlákno, jeden různě poskládaný a spojený řetězec pomocí disulfidických můstků
- tyto enzymy jsou zpočátku v inaktivním stavu, aby neškodily a neodbourávaly proteiny, které nemají
- teprve při po procestování ER a GA jsou z nich některé úseky vyštípnuty a tím se z nich vytvoří funkční enzym
Příkladem regulace zastoupením izoenzymů je laktát-dehydrogenáza.
- laktát-dehydrogenáza katalyzuje přeměnu pyruvátu na kyselinu mléčnou
- běžně se to děje v lidských svalech za nedostatku kyslíku, za intenzivní námahy (\(\implies\) zásobení tkáně kyslíkem není dostatečné na to, aby došlo k aerobnímu odbourávání)
- existují dva izoenzymy laktát-dehydrogenázy, M (muscle) a H (heart)
- jsou ze čtyř podjednotek a existuje řada forem enzymu, které se liší zastoupením M a H podjednotek
- srdce poměrně často využívá kyselinu mléčnou jako zdroj energie, na rozdíl od kosterních svalů
- v srdci je stálé a dokonalé zásobení kyslíkem a tam ta laktát-dehydrogenáza funguje opačným směrem: přeměňuje laktát na pyruvát
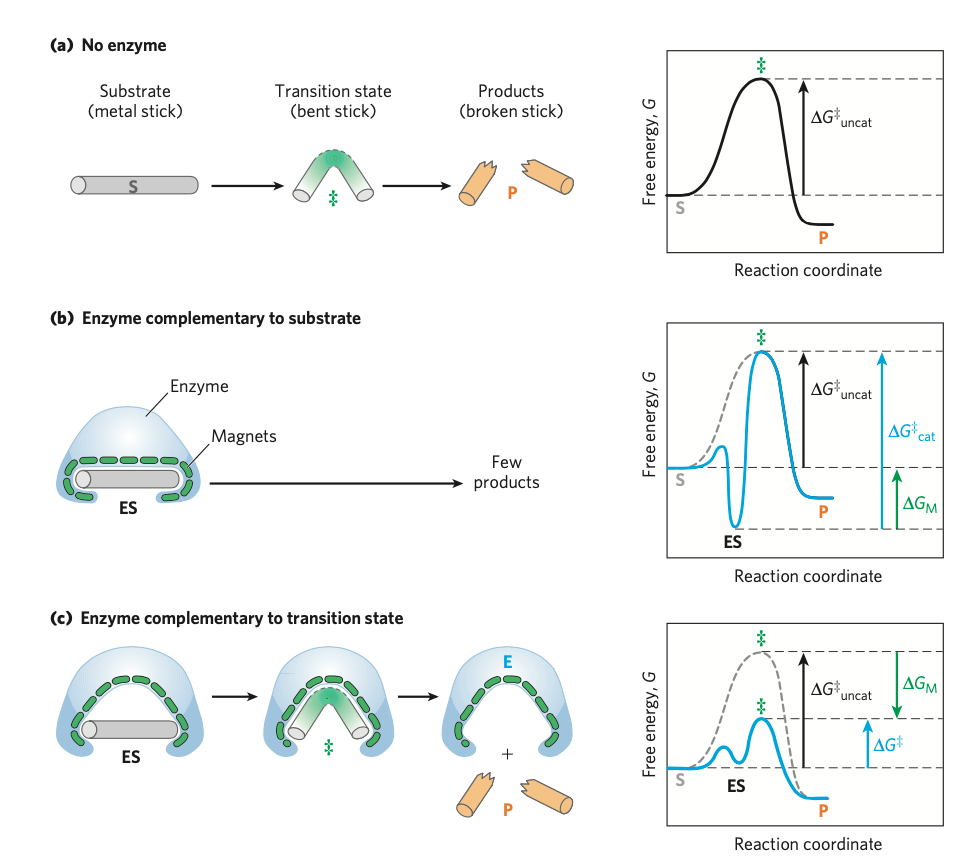
Jak enzymy pracují
Budeme se pro zjednodušení bavit o monosubstrátových reakcích, ačkoli převážná většina reakcí v těle je disubstrátových.
- Aktivační energie
- Energie, kterou musí molekula dostat, aby překonala energetickou bariéru a uvolnila energii (zreagovala).
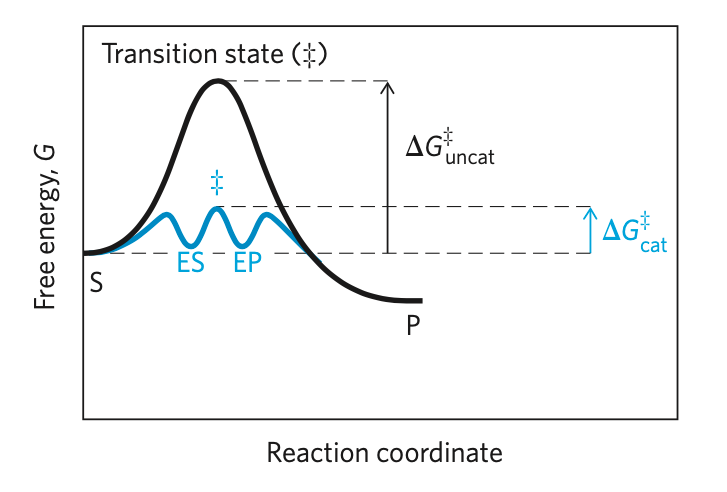
- aktivní místo a substrát vytvoří komplex enzym-substrát
- při této vazbě substrátu na aktivní místo dojde k řadě interakcí, při kterých se uvolní energie, a ta pak umožní průběh reakce
- enzymy pomáhají překonat peak (transition state) s vysokou Gibbsovou energií
- reálný rozdíl je mnohonásobně větší, než jde z obrázku poznat
- pravděpodobnost katalyzované reakce je mnohonásobně vyšší
O tom, jak konkrétně enzym snižuje potřebnou energii se zmiňuje několik různých teorií.
- substrát do enzymu “zapadne”, jak fyzicky (tvarem), tak chemicky
- mezi substrátem a enzymem vznikne množství nekovalentních interakcí, jako např. H-můstky, elektrostatické interakce, nepolární interakce
- kdyby to tak ale bylo ve skutečnosti, molekula prostě do enzymu zapadne a v klidu tam zůstane—k žádnému snižování energie by nedošlo
- vazebné místo odpovídá klíči jen přibližně a teprve při přichycení se začínají tvořit další vazby
- vznikne napětí a dojde ke změnám konformace substrátu i enzymu
- u toho se uvolňuje vazbená energie, takže reakce může probíhat snadněji
- vysvětlení na modelu kovové tyčky, viz obrázek
- tato teorie je experimetálně ověřena
Enzymová kinetika
Základní rovnice je rovnice Michaelise a Mentenové. Ti vycházeli z poznatků Victora Henryho.
- vychází se z toho, že molekuly substrátu a enzymu vytvoří komplex, vznikne produkt a enzym se regeneruje—tyto reakce jsou vratné a jsou charakterizovány rychlostními konstantami
\(k_1\) vznik komplexu enzym-substrát\(k_{-1}\) rozpad komplexu\(k_2\) vznik produktů a regenerovaného enzymu
Nechť sledujeme rovnici
poté základní rovnice M-M vypadá následovně
kde
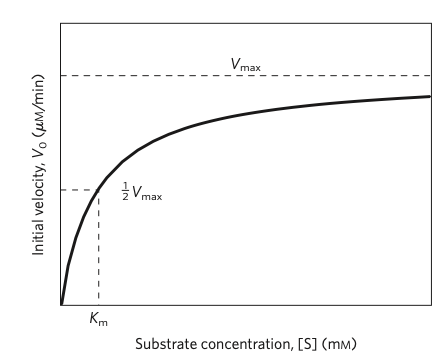
Jak jde vidět z obrázku,
Graf můžeme linearizovat (vznikne dvojitě reciproční graf), aby bylo jednodušší vyčíst z něj hodnoty
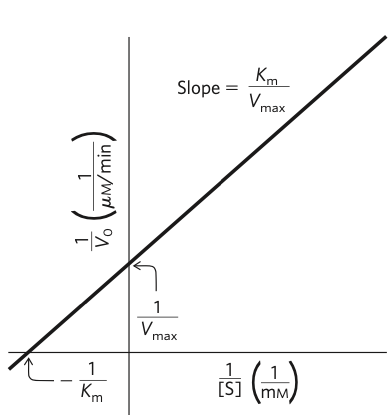
Někdy se uvádí také katalytická konstanta
kde
Protože koncentrace substrátu in vivo je mnohem nižší než aby mohlo být dosaženo maximální rychlosti, zavádí se ještě konstanta specificity, která se počítá jako poměr
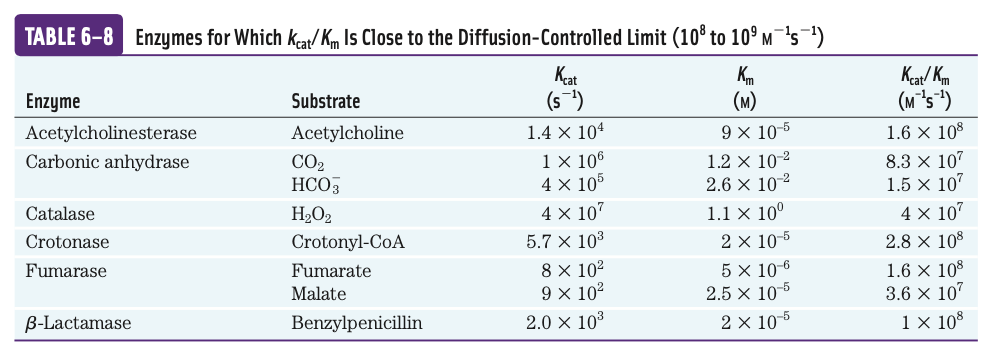
- odbourává v peroxisomech peroxid vodíku, mění jej na vodu a kyslík
- má sice vysokou katalytickou konstantu, avšak také
\(K_M\) (není jen tak ochotna začít pracovat)
- odbourává nervový přenašeč acetylcholin na neurosvalové ploténce
- vychází dobře z tabulky výše, dosáhla vlastně enzymové dokonalosti (o moc lépe už to nejde)
- reaguje s hexózami
- M.konstanta pro fruktózu je třicetkrát vyšší, než pro glukózu
- když někde bude stejně glukózy a fruktózy, tak bude mnohem raději reagovat s glukózou
Enzymová inhibice
Často probíhá skrze farmaka.
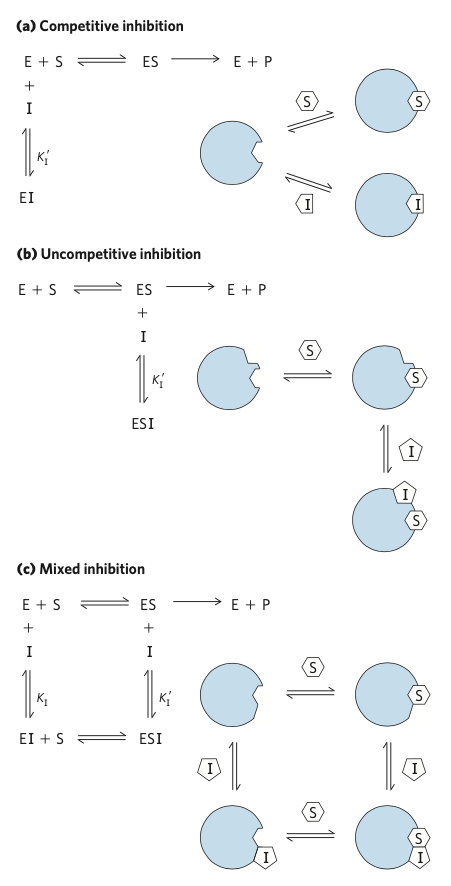
Kompetitivní inhibice
- o vazebné místo soutěží substrát a inhibitor
- inhibitor není metabolizovatelný a tak když se tam naváže, neděje se už nic
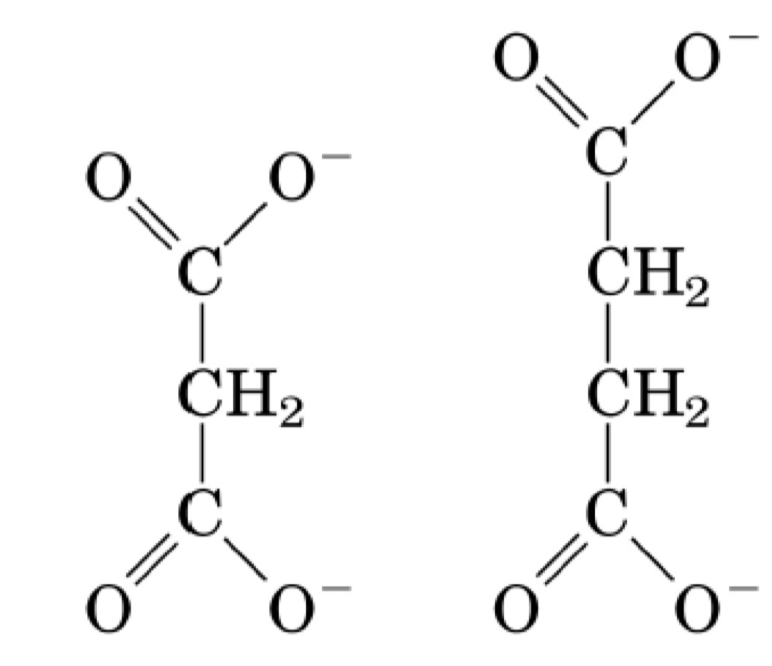
- typickým příkladem je inhibice sukcinát-dehydrogenázy malonátem
- sukcinát-dehydrogenáza je enzym v Krebsově cyklu
- dalším příkladem je léčba metanolové otravy
- zvyšuje se koncentrace ethanolu jako správného substrátu, ze kterého vzniká neškodný acetaldehyd, oproti metanolu jako špatného substrátu, ze kterého vzniká formaldehyd
- nemění se
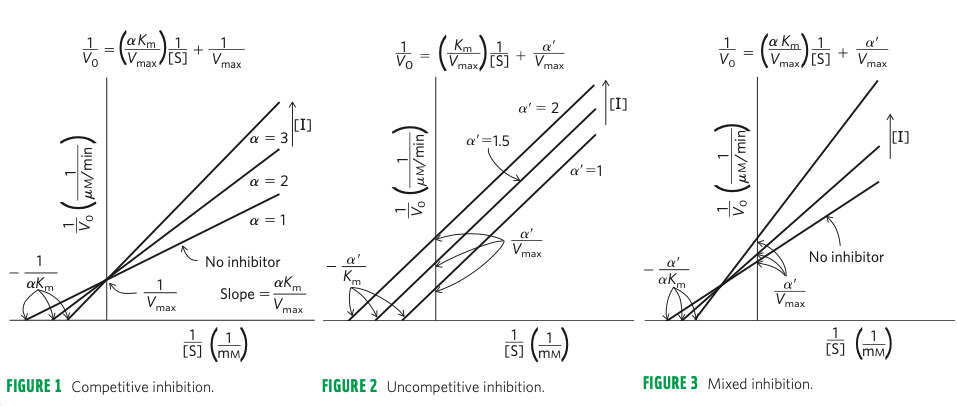
\(V_{max}\) , ale mění se\(K_M\) (viz FIGURE 1)
Akompetitivní inhibice
- vazba inhibitoru na enzym je podmíněna vazbou substrátu
- po navázání substrátu se nějak změní struktura enzymu a vznikne nové vazebné místo, na které se naváže inhibitor
- způsobeno změnou konformace
- mění se jak
\(V_{max}\) , tak\(K_M\) (viz FIGURE 2)
Smíšená inhibice
- může se stát úplně všechno, inhibitor se naváže před substrátem, po substrátu
- mění se obě hodnoty, ale vždy se jedno zvyšuje a druhé snižuje (viz FIGURE 3)
Ireverzibilní inhibice
Tři druhy zmíněné výše se daly “přebít” zvýšením koncentrace substrátu. Následující inhibice jsou však nevratné.
- protizánětlivá látka, proti horečnatým stavům
- funguje na úrovni syntetické dráhy tak, že modifikuje
\(\ce{OH}\) zbytek enzymu\(\ce{COX}\) a ten pak už nemůže tvořit záněty a horečky - horečka by měla sloužit jako obranný mechanismus proti infekci a je otázka, zda je dobré se ji snažit srazit
- nesmí se po něm požívat alkohol
- obsahuje ireverzibilní inhibitor alkohol-dehydrogenázy (je v něm látka, která se jinak používá k léčbě alkoholismu), dráhu zablokuje u přeměny acetaldehydu na kyselinu octovou
- acetaldehyd se pak hromadí v těle
Vliv pH na enzymy a bisubstrátové reakce
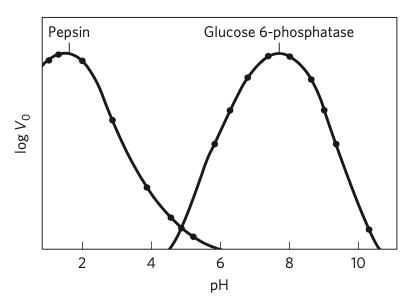
- enzymy se obecně vyznačují tím, že fungují v mírných podmínkách (pH 7.4), ale není to 100 % pravda
- např. pepsin (a jiné žaludeční enzymy) má optimum kolem pH 2
- známe i takové, které fungují nezávisle na pH (papain)
- extrémy jsou však i v buňce, např. enzymy v lysosomech jsou aktivní až v pH 5 (jinak by rozložily ER i GA)
Bisubstrátové reakce jsou v těle vůbec nejčastější.
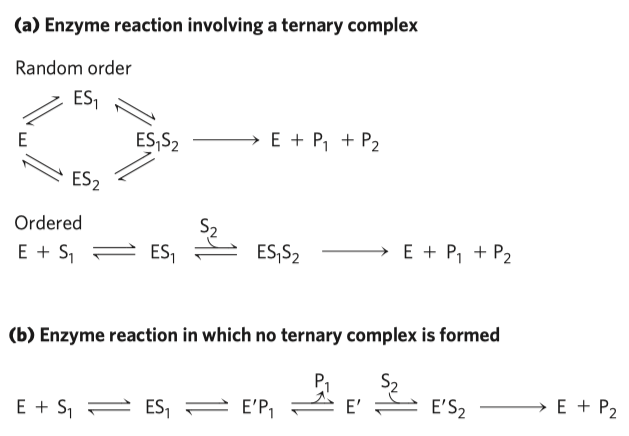
- reakce, které zahrnují tvorbu ternárního komplexu
- substráty se na enzym vážou buď v náhodném pořadí, nebo v přesně uspořádaném pořadí
- teprve po navázání jednoho substrátu se vytvoří vazebné místo pro druhý
- naváže se první substrát a vznikne první produkt, v průběhu reakce dojde ke změně konformace enzymu tak, že je schopen navázat druhý substrát, vznikne druhý komplex a následně druhý produkt
- a tak dokola
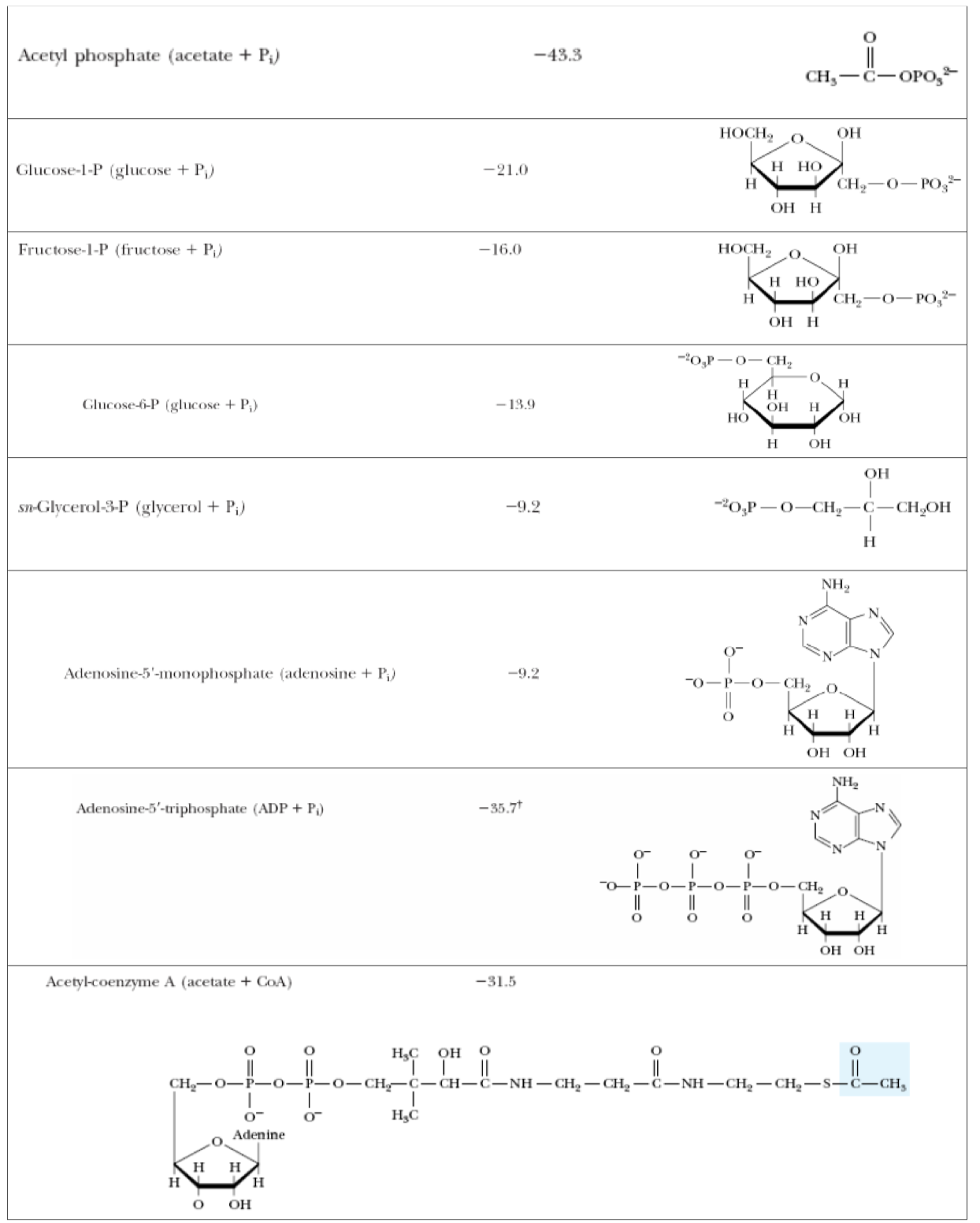
Makroergní molekuly
- nejznámější jsou ATP a spol., ale nejsou jediné
- obecně jejich hydrolýzou vznikne více energie než
\(\pu{30 kJ/mol}\) (případně\(\pu{25 kJ/mol}\) ) - někdy je to sporné
- např. glukóza se považuje za energetickou molekulu, přestože se její hydrolýzou tolik energie neuvolní
- musí se v mnoha enzymových krocích pracovat, aby se z ní ta energie dostala
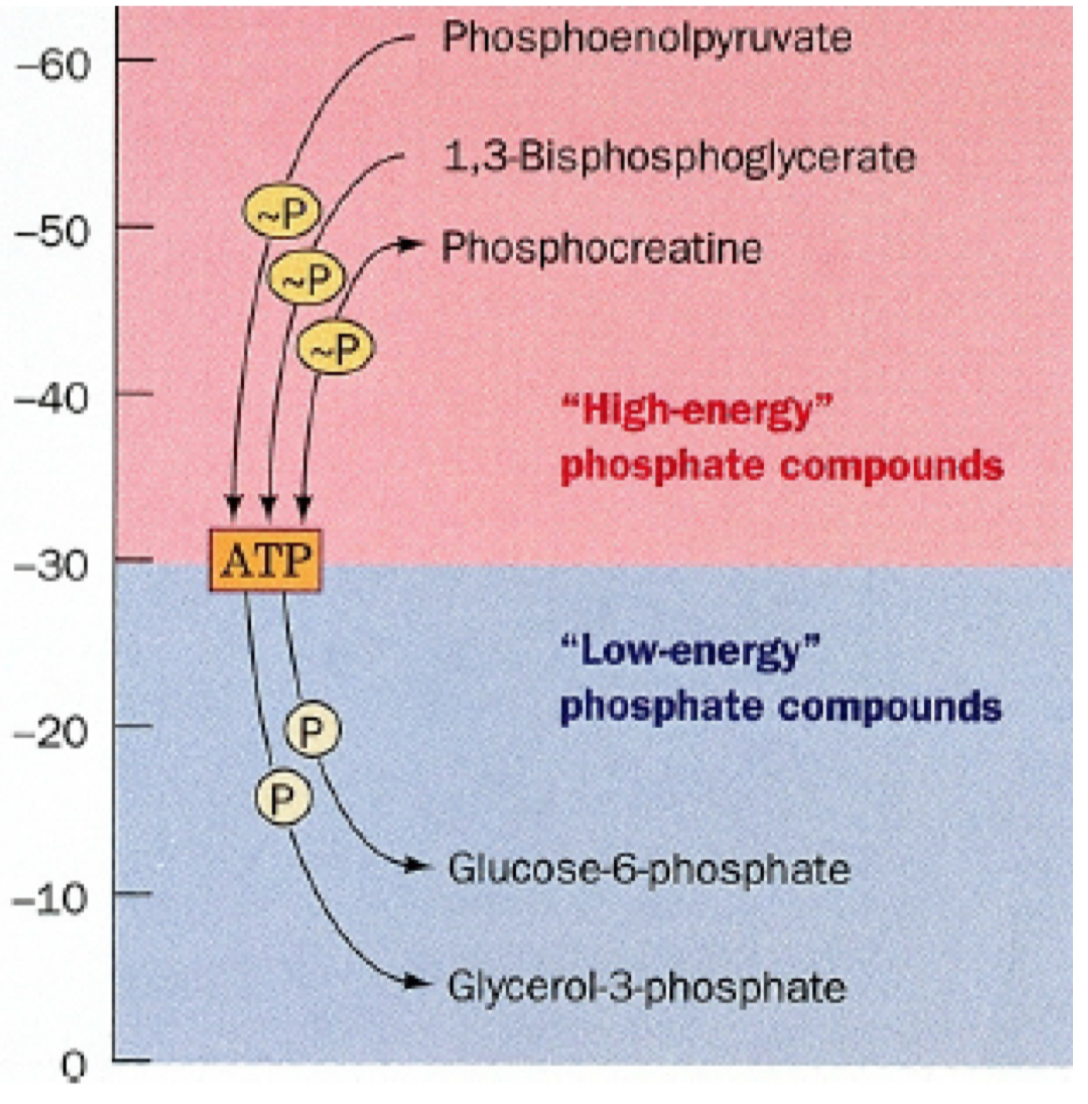
Na obrázku jsou seřazeny molekuly od té s nejvyšší energií po tu s nejnižší. Nejvyšší má pyruvát,
- enolfosfáty
- zde je i úplně energeticky nejbohatší molekula, fosfoenolpyruvát (objeví se při glykolýze)
- thioestery:
- např. difosfoglycerát (také se objeví při glykolýze)
- mohou sloužit jako koenzymy
- acylfosfáty: fosfoderiváty organických sloučenin
- např. 1,3-bisfosfoglycerát (opět z glykolýzy)
- fosfageny: zásobní látky
- např. fosfokreatin (
\(\pu{43 kJ/mol}\) ), u člověka je ve svalech jako nejrychlejší zásobárna energie- může vstupovat do reakce kreatin + ATP, vzniká fosfokreatin a ADP, to se děje, je-li fosfát v nadbytku; jinak se reakce otočí
- např. fosfokreatin (
- sloučeniny s pyrofosfátovou vazbou: všechny nukleosid-trifosfáty
- ATP, GTP, UTP, CTP atd.
- účastní se tvorby nukleotidů
- mohou se štěpit různými způsoby, v buňce však probíhá pouze hydrolýza ATP na ADP a fosfát
- pyrofosfátové štěpení je na AMP a pyrofosfát, tam je větší zisk energie
- univerzální přenašeč acylů
- vazba mezi ním a merkaptoskupinou, kterou má na konci, je také makroergní

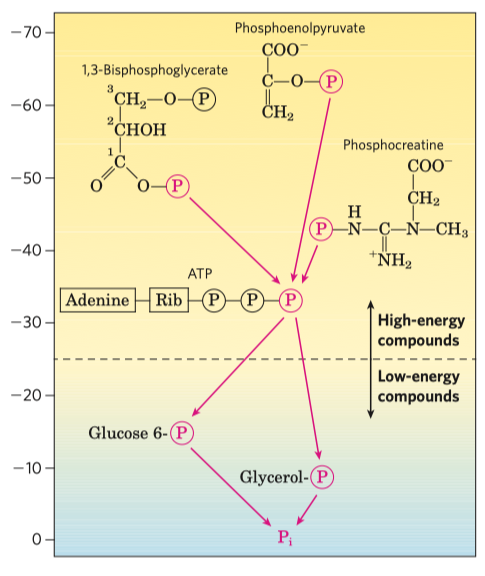
ATP
- velice stabilní, i když má tolik energie, protože má vysokou aktivační energii hydrolýzy
- struktura
- adenin, báze
- cukr, pentóza (ribóza)
- trifosfát, tři molekuly fosfátu
- samotné bázi se říká adenin a s cukrem je to adenozin
- člověk vyrobí
\(\pu{64476 g}\) ATP za den (váží-li\(\pu{75 kg}\) )
- za fyziologického pH se oddělí vodíky od fosfátů, původní
\(\ce{OH}\) skupiny nesou záporné náboje a vzniká velké odpuzování skupin—v tom pnutí tkví ta makroergnost - není to vlastně v samotné vazbě, ale v uvolnění molekuly při štěpení.
- buďto orthofosfátové štěpení, to je to normální (na ADP a fosfát), odštěpí se γ fosfát
- nebo pyrofosfátové štěpení, oddělí se pyrofosfát (neboli také difosfát), vznikne AMP a PP (pyrofosfát)
- při tomto štěpení se uvolní více energie, pro některé reakce v buňce nestačí těch
\(\pu{30.5 kJ/mol}\) —u této reakce se totiž následně hned pyrofosfatázou štěpí PP na P + P, u čehož se uvolní další energie navíc
- při tomto štěpení se uvolní více energie, pro některé reakce v buňce nestačí těch
- ATP umí přebírat energii od jiných makroergních sloučenin a dále ji předávat jiným, běžným molekulám (viz obrázek výše)
- samotné předávání probíhá ve dvou krocích (viz obrázek níže)
- vzniká fosforylovaný meziprodukt, který je vázaný na enzym
- dojde k navázání (zde) aminoskupiny a uvolnění fosfátu
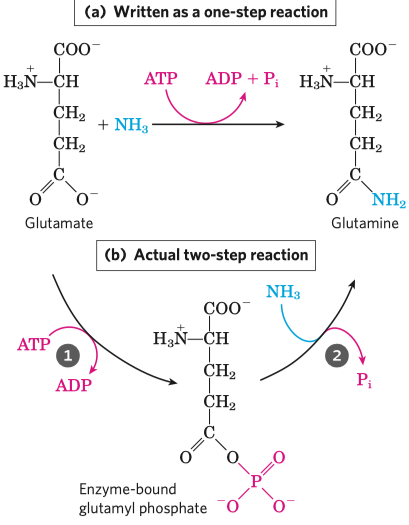
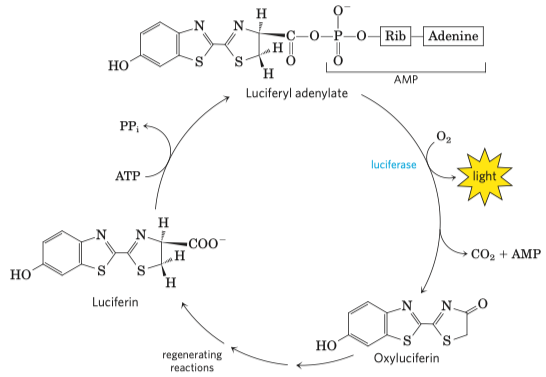
- luciferin je aktivován adenylací, využije se ATP
- enzym luciferáza
Metabolismus a enzymologie
Živé organismy jsou z termodynamického hlediska otevřené systémy v ustáleném stavu.
- Ustálený stav
- Ustálený stav je flexibilním stavem s maximální možnou termodynamickou účinností. Je charakteristickým stavem pro živé systémy.
V rámci metabolismu si ve větším detailu na několika příkladech popíšeme, k čemu na struktuře enzymu dochází. Všechny reakce jdou popsat reakční trajektorií, kde se na
- přinášejí schopnost katalyzovat reakce za (pro organismus) běžných podmínek
- jsou specifické (např. konkrétní enzym by mohl reagovat jen s jediným cukrem)
- s několika cukry může běžet několik reakcí katalyzováných různými enzymy, které mohou být nezávisle na sobě regulovány
- veliký počet reakcí probíhá v jediném kompartmentu či v několika málo kompartmentech (např. v ER nebo v
mch ); současně je tam ohromně moc regulovaných reakcí, ale ty se díky specifitě vzájemně neovlivňují - dává vzniknout danému konkrétnímu izomeru
- jsou regulovatelné tím, že měníme dostupnost substrátu a reaktantů
- když se koncentrace substrátu sníží pod určitou minimální hranici, enzym už ho neuvidí, s katalýzou se přestane
- jsou regulovatelné i “seshora” buňkou, která může dle potřeby měnit svou expresi
Princip katalýzy
Běžné mechanismy katalýzy, avšak kombinované na jedné molekule: vedou k vysoce specifickým reakcím s vysokými výtěžky a s vysokou účinností. Je minimalizován vznik nežádoucích vedlejších produktů.
Acidobazická katalýza
- aktivnímu centru nabídneme kyselinu nebo zásadu
- přenos protonu od Brønstedovy kyseliny nebo na Brønstedovu zásadu snižuje volnou energii přechodového komplexu
- typicky je součástí: hydrolýzy esterů, peptidů, reakcí fosfátových skupin, tautomerizací (keto-enol)
- např. hydrolýza RNA v rámci reakce ribonukleasy A
- imidazolová skupina na histidinu 12 bude odjímat proton, což nakonec povede ke štěpení vazby; později se bude chovat naopak jako kyselina a odcházející skupině proton poskytne
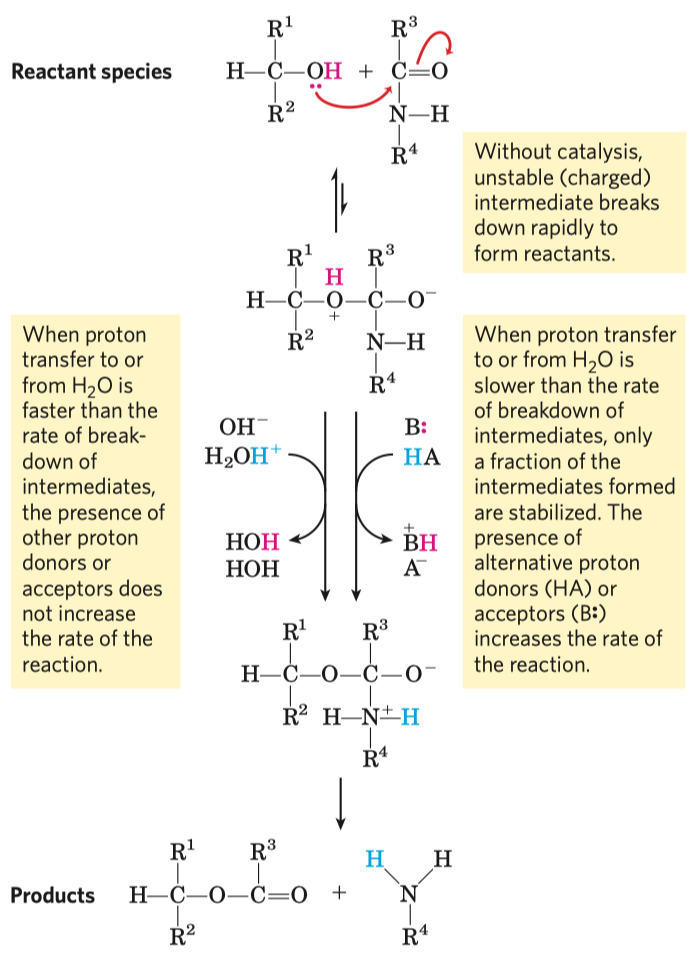
Kovalentní katalýza
- přechodně se tvoří vazba mezi katalyzátorem a substrátem
- nukleofilní reakce mezi katalyzátorem a substrátem za tvorby kovalentní vazby
- posun elektronů z reakčního centra (na substrátu) směrem k elektrofilnímu centru katalyzátoru—tato změna usnadní změnu uspořádání reakčního centra
- eliminace katalyzátoru (obrácení první reakce)
- vznik kovalentní vazby umožní změnu uspořádání a průběh reakce, katalyzátor pak bude zase oddělen
- rychlostně limitující fází katalyzované reakce je buď fáze nukleofilní, nebo elektrofilní (dle toho je pak katalytický efekt souhrnně označován)
- dobrý kovalentní katalyzátor: vysoce nukleofilní a zároveň snadno eliminovatelný
Např. z reakce
se po katalýze stane reakce
- aminoskupina Lys, thiolová Cys, karboxylová Asp, hydroxylová Ser, imidazolová His
- koenzymy thiamin pyrofosfát (dále jen TPP) a pyridoxalofosfát
Katalýza kovovými ionty
- Metaloenzymy
- Mají pevně vázané kovy (Fe, Cu, Zn, Mn, Co), využívají je pro vazbu a orientaci substrátu, pro oxido-redukční reakce. Polarizují substrát.
- Enzymy aktivované kovovými ionty
- Volně váží kovové ionty (především ionty kovů alkalických zemin: Na, K, Mg, Ca) z roztoku, vyžadují je pro svoji aktivitu.
- vazbou/orientací substrátů
- zprostředkováním oxido-redukčních reakcí
- elektrostatickou stabilizací nebo stíněním negativních nábojů
- katalyzuje vznik hydrogenuhličitanu z oxidu uhličitého (jinak by se
\(\ce{CO2}\) hromadil v tkáních) - proces
- zinek je koordinován imidazolovými skupinami v aktivním centru
- stabilizuje a polarizuje substrát.
- molekuly vody tvoří network elektrostatických interakcí
- další imidazolová skupina (z His) se přiklání k molekule vody a tvoří se řetězec
- molekula vody je polarizována
- imidazolová skupina působí nukleofilně
- polarizace molekuly vody umožní nukleofilní reakci ve směru substrátu
- zinek je koordinován imidazolovými skupinami v aktivním centru
Elektrostatická katalýza
- eliminace vody z aktivního centra vede ke snížení dielektrické konstanty a k zesílení elektrostatických interakcí
- uspořádání nábojů v aktivním centru konstanty stabilizuje přechodové stavy reakcí
- distribuce nábojů kolem aktivního centra přivádí substrát do centra rychleji než by tomu bylo prostou difuzí
Například hexokinázová reakce, ve které figuruje i hořečnatý iont.
Katalýza proximitním a orientačním efektem
- stabilizace relativní orientace skupin vůči sobě a omezení jejich pohybu
- opět např. u hexokinázové reakce
- hydroxylová skupina glukózy atakuje elektrondeficientní γ-fosfát ATP
- skupina musí přistupovat ke druhé molekule reaktantu (γ-fosfátu) tak, že je orientována ve směru osy vazby

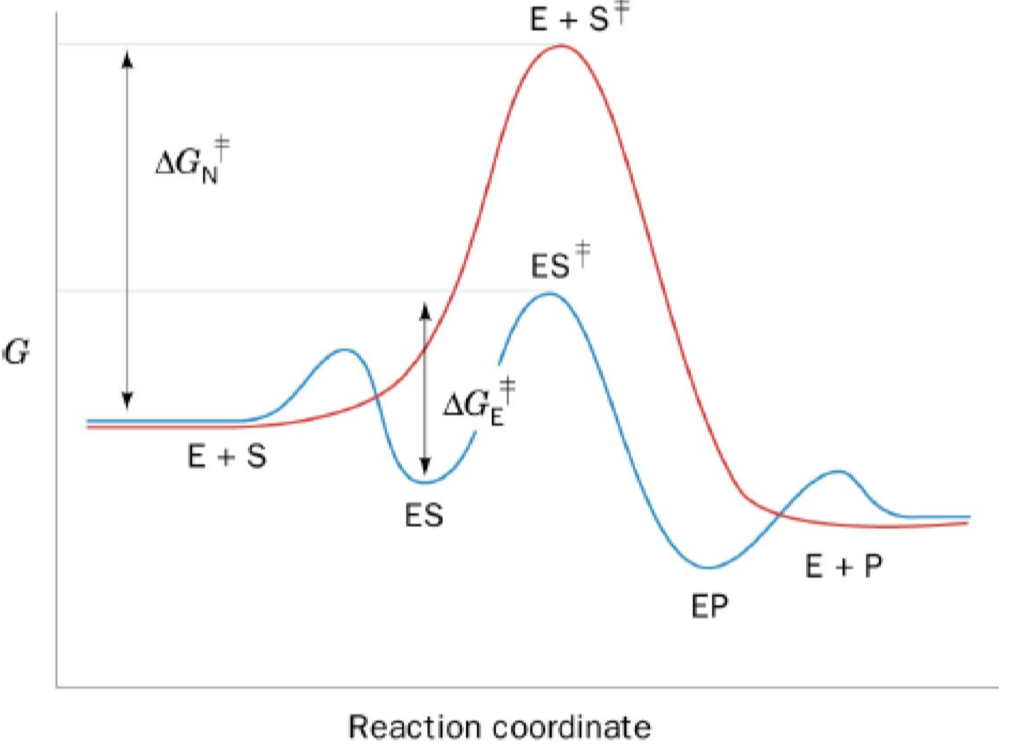
Katalýza preferenční vazbou přechodového stavu
- nejvýznamnější
- enzym váže přechodový stav s relativně vyšší afinitou než substrát nebo produkt
- prefenční vazba přechodového stavu zvyšuje jeho koncentraci, což se odrazí ve zvýšení rychlosti reakce
- snižuje peak ES komplexu, který se může rozpadnout na dvě strany: ES a nebo E + P (z toho se poté hůř vrací, viz obrázek)
Chymotrypsin
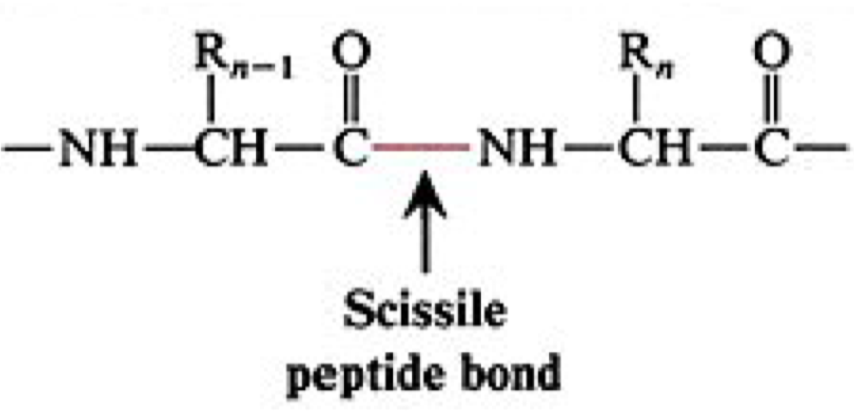
- proteináza, která je aktivní jako enzym zodpovědný za štěpení živin v trávicím traktu
- obecný mechanismus proteolýzy je ale všudypřítomný a nepostradatelný pro život
- procesů závislých na proteolýze je nespočet (signální, ontogenetické, atd.)
- dochází ke štěpení peptidové vazby, peptidová vazba je substituovaná vazba mezi dvěma zbytky AK
- budou si vybírat peptidové vazby jen v sousedství určitých R skupin
- např. pro chymotrypsin musí na
\(R_{n-1}\) být nějaký velký aromatický zbytek a na\(R_n\) nesmí být prolin - pro trypsin na
\(R_{n-1}\) musí být arginin nebo lysin- požadavek na arginin je sice dosti řídké síto, ale to přesně chceme (štěpit peptidy na mnoha místech)
- větší specificita někde jinde v buňce by byla např. zařízena požadavky na
\(R_{n-3}\) a\(R_{n-2}\)
Mechanismus serinové protolytické reakce
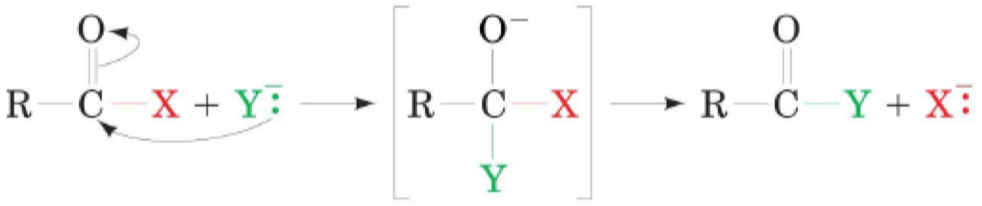
- přenos acylové skupiny, který bude zahrnovat tvorbu přechodového stavu (intermediátu)
- intermediát bude ve tvaru čtyřstěnu, uhlík bude uprostřed a substituenty ve vrcholech
- přechodový stav bude charakterizován oxy-aniontem
- nabízí se pole pro elektrostatickou katalýzu, výskyt této molekuly budeme moci stabilizovat nabídnutím kladných částic do okolí
- přenos bude ukončen vpravo, kdy dojde k uvolnění substituentu, tedy k rozštěpení peptidové vazby a uvolnění nového konce proteinu
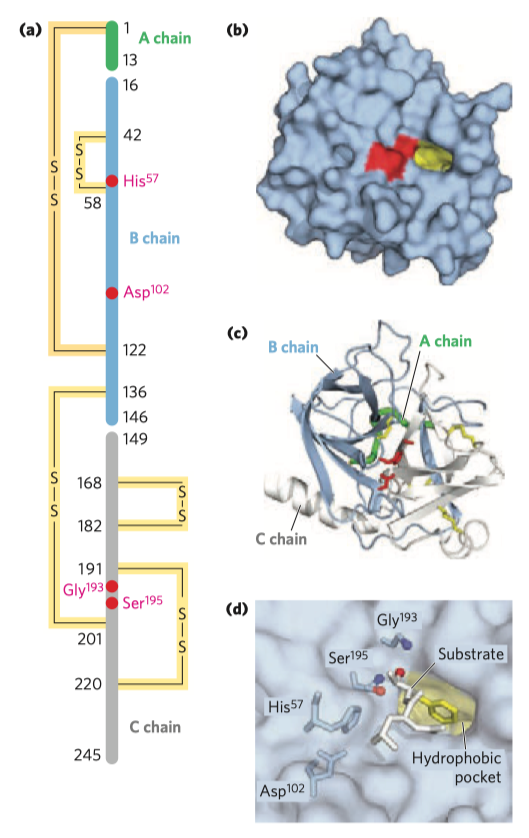
- katalytická triáda
- Ser 195 (hydroxylová skupina), His 57 (imidazolová skupina) a Asp 102 (karboxylová skupina)
\(\ce{OH}\) skupina Ser a její nukleofilní působení začíná celý proces štěpení vazby
- Ser 195 (hydroxylová skupina), His 57 (imidazolová skupina) a Asp 102 (karboxylová skupina)
- hydrofobní kapsa
- do ní se váže peptidový řetězec, z jejího tvaru plyne požadavek na velkou hydrofobní AK na pozici
\(R_{n-1}\) v substrátu- tato hydrofobní interakce dodá vazebnou energii pro substrát, vznik E-S komplexu
- každá peptidáza je trošku jiná, každá bude mít trochu jiný požadavek na skupiny, které se tam mají nacházet
- do ní se váže peptidový řetězec, z jejího tvaru plyne požadavek na velkou hydrofobní AK na pozici
- oxyaniontová díra
- uspořádání nukleofilních skupin, které by byly k dispozici pro případný oxy-aniont, který by se v jejich blízkosti vyskytl
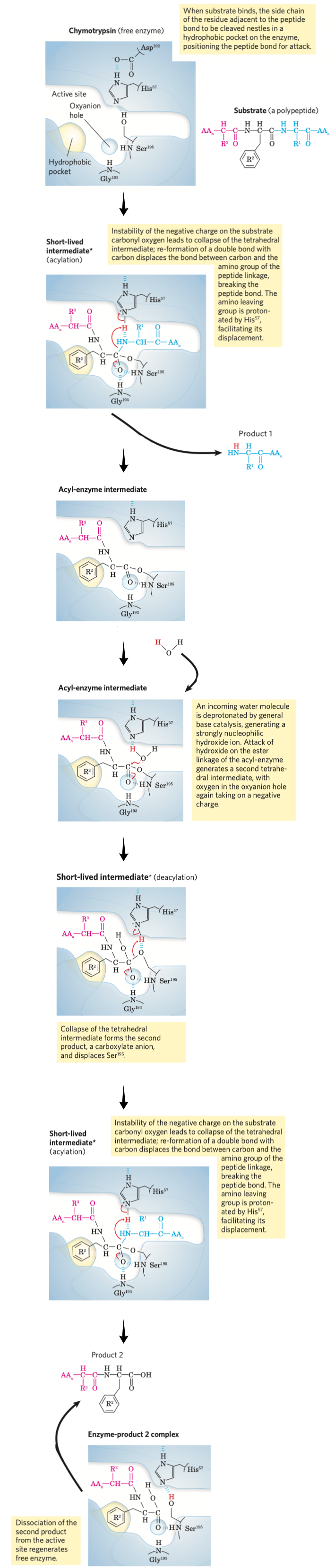
- Ser je v triádě aktivovaný, chová se jako skvělé nukleofilní činidlo (a)
- vzájemné elektrostatické působení
- Ser získává unikátní vlastnosti
- dojde k nukleofilnímu ataku, tvoří se tetrahedrální přechodový stav (c)
- současně s tím byl odejmut proton z hydroxylové skupiny serinu, čemuž napomáhá blízkost imidazolové skupiny na pozici 57
- acidobazická katalýza, zároveň vzniká kovalentní intermediát, tedy i kovalentní katalýza, navíc se uplatňuje i proximitní a orientační efekt
- přechodový stav se rozpadá za štěpení peptidové vazby a vzniku komplexu enzym-[část původního substrátu] (e)
- není stabilní, je to jen metakomplex, dochází k němu pouze v okamžiku překonávání bariéry
- vazba molekuly vody, hydrolýza peptidové vazby, podruhé dochází k tvorbě čtyřstěnového intermediátu (g)
- intermediát se znovu rozpadá za vzniku karboxykonce uvolňovaného s enzymem (i)
Reakce má tedy dvě fáze, v obou dochází k nukleofilnímu působení: v tom prvním využíváme hydroxylovou skupinu serinu a dochází ke štěpení peptidové vazby, ve druhém použijeme molekulu vody, opět vzniká čtyřstěnový intermediát a pak dochází ke štěpení vazby na Ser 195 a uvolnění nového C konce.
- imidazolová skupina His bude na konci reakce usnadňovat protonaci hydroxylové skupiny—slouží tam jako takový katalyzátor, nejdříve protony sebere, pak je zase vrátí
- intermediát je pokaždé nabitý, oxy-aniont zde musí být stabilizován
- to se děje tím, jak je vystrčen do okolí
\(\ce{NH}\) skupin, které jsou s ním schopny elektrostaticky interagovat
- to se děje tím, jak je vystrčen do okolí
- pomocí cílených bodových mutací (např. Asp) se dá ověřit, že je daná AK důležitá pro efektivitu enzymu
- tvoří se nízkobariérové vodíkové můstky
- \(\impliedby\) Asp a His mají podobné hodnoty
\(pK'\)
- \(\impliedby\) Asp a His mají podobné hodnoty
Přirozená regulace
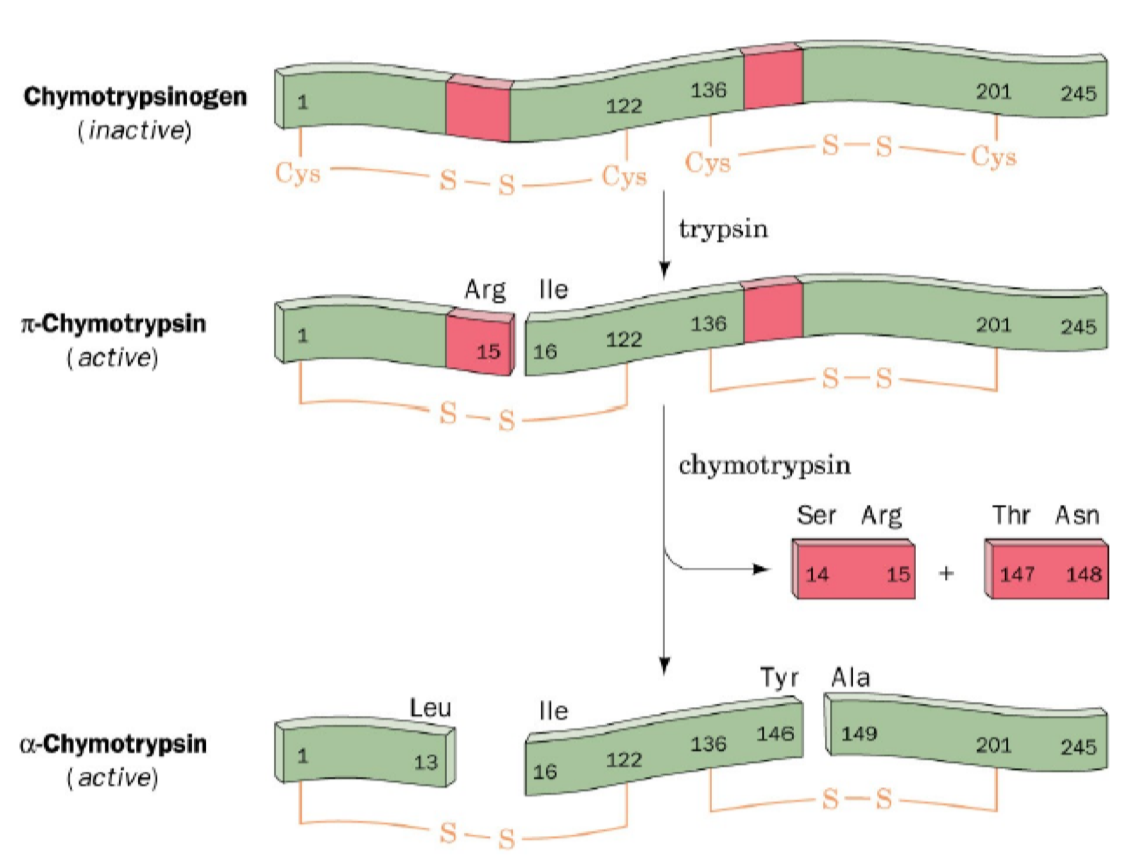
- také pracuje s tvarem enzymu
- aktivní chymotrypsin vzniká z neaktivního prekurzoru (chymotrypsinogen) jeho štěpením
- mezi zbytky 15 a 16 probíhá proteolytické štěpení, které používá příbuznou proteázu, trypsin
- vzniká částečně aktivní chymotrypsin
- Ser se do blízkosti triády posune až štěpením
- chymotrypsin je autokatalyticky štěpen, vyštěpí se červené části
- konečný produkt je pospojován do jednoho celku S-S můstky
Další možnosti regulace jsou např. existence neštěpitelného pseudosubstrátu, který blokuje aktivní místo, nebo nepřítomnost kofaktoru, který k činnosti enzymu nezbytný.
Sacharidy a glykolýza
- Monosacharidy
Monosacharidy jsou aldehydové (aldózy) nebo ketonové (ketózy) deriváty polyhydroxyalkoholů s alespoň třemi uhlíky v řetězci. Od složitějších sacharidů se liší tím, že je nelze hydrolyzovat na jednodušší látky.
Nejstabilnější jsou cyklické sacharidy, většinou mají 5 nebo 6 uhlíků.
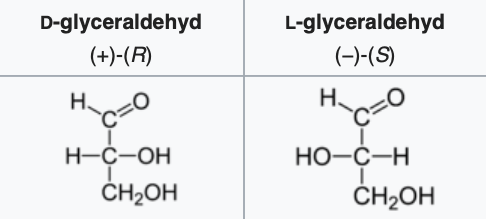
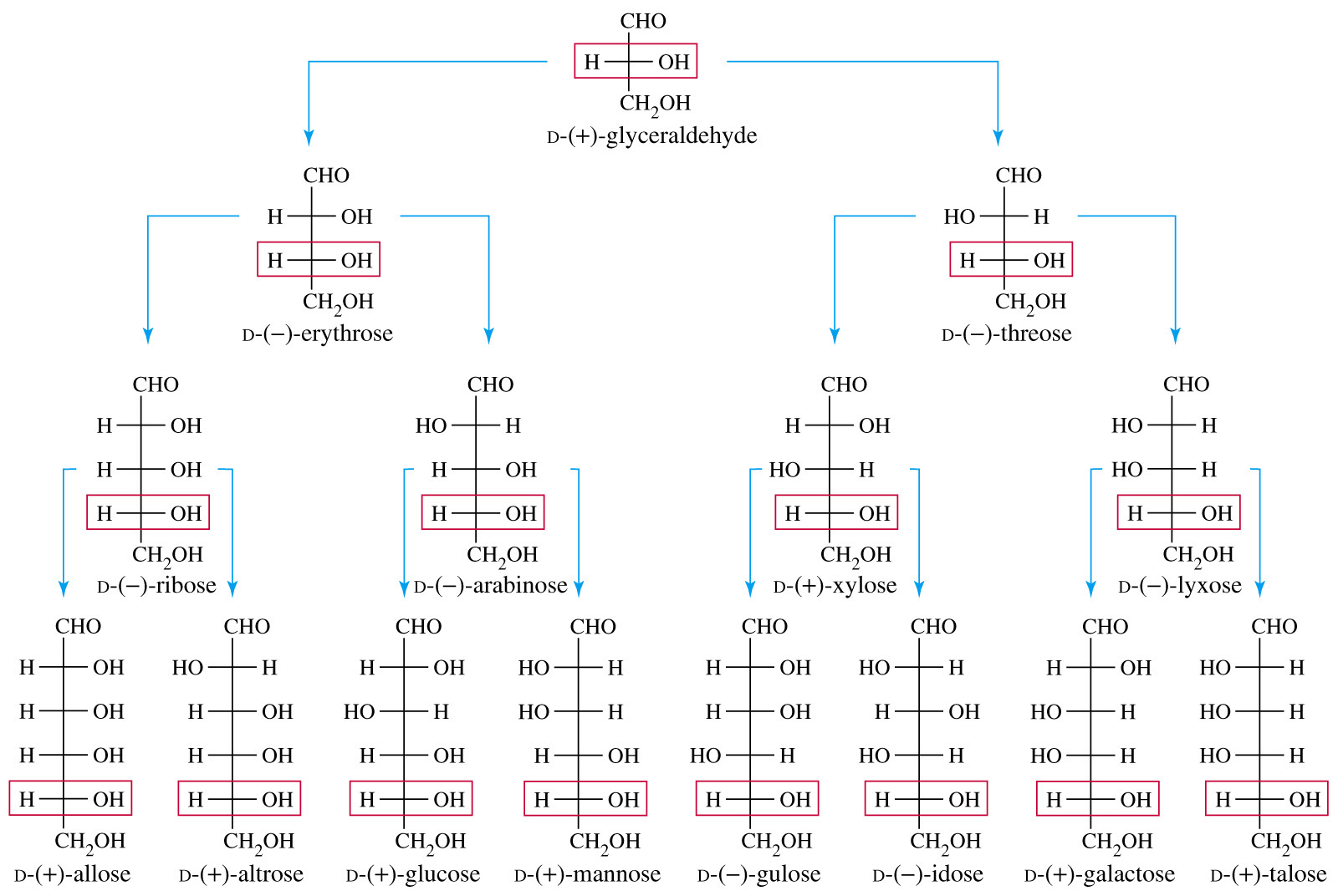
- D a L forma
Sacharidy jsou opticky aktivní látky: aldóza s
\(n\) uhlíky má\(n-2\) chirálních center (všechny kromě prvního a posledního), ketóza by měla\(n-3\) (ještě minus ten s keto skupinou). Takové látky pak tvoří\(2^k\) izomerů, kde\(k\) je počet chirálních uhlíků.D forma je taková, kdy
\(\ce{OH}\) skupina nejvzdálenější od\(\ce{C=O}\) skupiny (na obrázcích většinou ta spodní) má stejnou konformaci jako D-glyceraldehyd—je napravo.
- zásobní funkce (glykogen, škrob)
- zdroj energie
- signální funkce (heteropolysacharidy, proteoglykany)
- stavební funkce (celulóza, exoskelet bezobratlých)
Významné aldózy a ketózy
- aldohexóza, hroznový cukr
- centrální metabolit, hlavní zdroj energie napříč organismy
- jeden z mála monosacharidů, které se vyskytují ve formě monomerů v celé řadě buněk
- někde se můžeme setkat i s názvem dextróza (což je označení pouze pro D-formu)
Dále ještě galaktóza (je součástí laktózy, sacharidu, který se vyskytuje v mléce placentálů), manóza a idóza—poslední dvě zmíněné jsou v mezibuněčné hmotě v podobně glykosamidoglykanů. Z aldopentóz poté ribóza, která je součástí DNA a RNA.
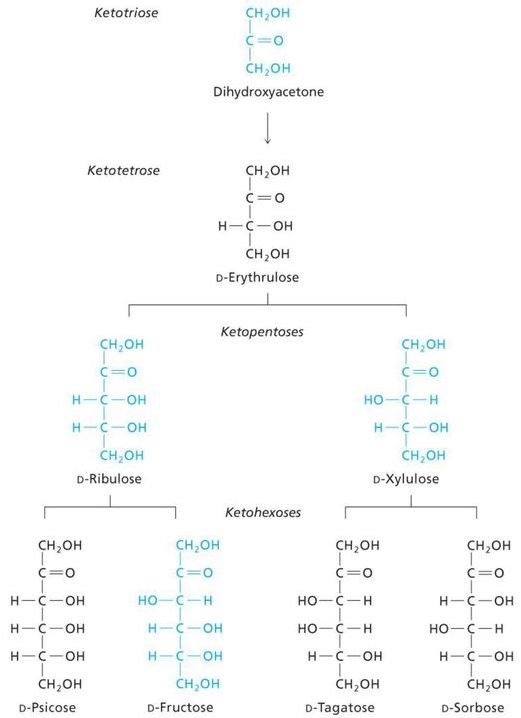
D-fruktóza (častý zdroj energie, důležitý metabolit některých drah, je v medu, v sacharóze) a D-ribulóza (účastní se metabolismu pentózo-fosfátové dráhy a zejména fotosyntézy).
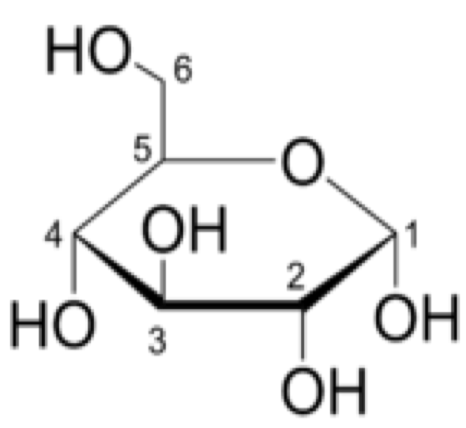
Cyklické formy
- aldehydová a ketoskupina jsou reaktivní a mají tendenci reagovat s alkoholy na druhé straně molekuly
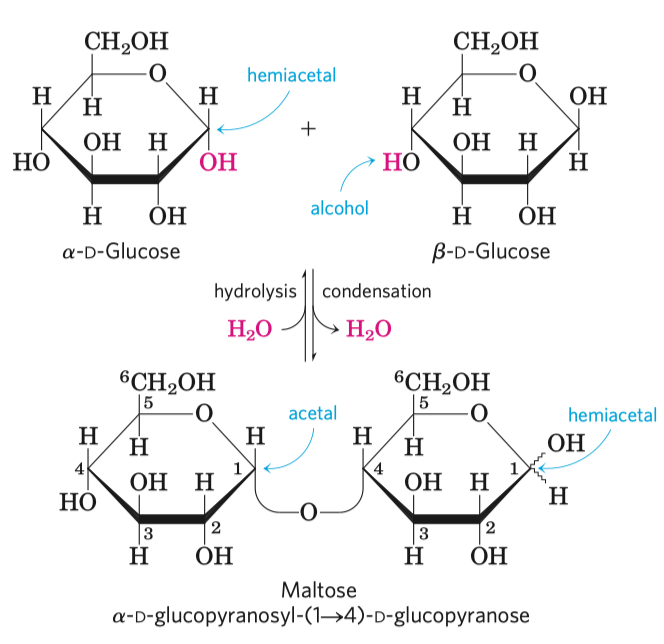
- alkoholová + aldehydová skupina \(\rightarrow\) hemiacetál (s keto je to hemiketal)
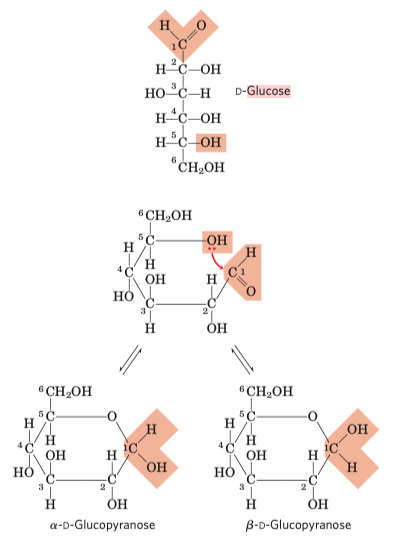
- “pyro” \(\impliedby\) odvoditelné od pyranu, šestičetného cyklu
- α/β \(\impliedby\) na prvním uhlíku je nové chirální (tzv anomerní) centrum, vznikají dva anomery
- Haworthova projekce
- podobně pro fruktózu (α/β D-fruktofuranóza)
- α/β formy vznikají v určitém poměru (typickém pro daný cukr)
- po určité době nastane v roztoku rovnováha, výsledný úhel stočení světla je dán váženým průměrem obou forem
- kdyby obě formy stáčely o stejně velký úhel (s opačným znaménkem), a byly v roztoku v poměru 1:1, výsledný roztok by světlo nestáčel (tzv. racemát)
Cyklické sacharidy se vyskytují ve vaničkové a židličové konformaci; židličková je ta stabilnější \(\implies\) častější.
Deriváty monosacharidů
- Aldolové kyseliny
- Vznikají oxidací aldehydové skupiny. Typicky nejsou v lineární podobě, jejich skupiny opět reagují s těmi alkoholovými—probíhá esterifikace, reakce kyseliny s alkoholem, vznikají laktony. Nejdůležitější lakton je kyselina-L-askorbová (vitamín C).
- Alduronové kyseliny
- Vznikají oxidací uhlíku na jiné skupině.
- Alditoly
- Vznikají redukcí aldehydové skupiny.
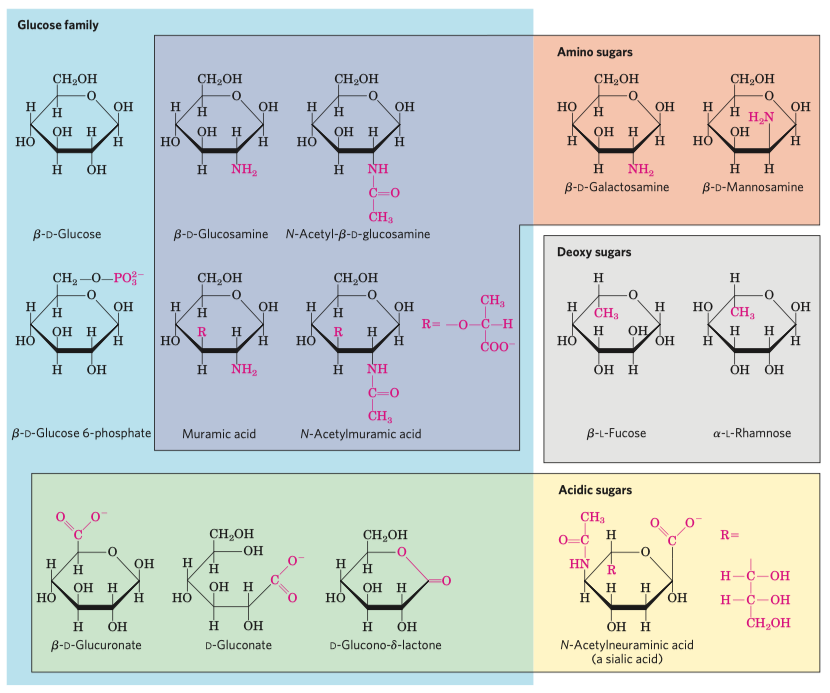
- mají místo hydroxyskupiny jen vodík.
- např. rhamnóza a fukóza, složky zásobních polysacharidů nižších rostlin.
- N-acetylglukosamin (odvozen od glukózy a N-acetylu)
- skupina je často vázaná na složku buněčných stěn bakterií a je i podjednotkou chitinu
- N-acetylmuramová kyselina, složka buněčných stěn bakterií (\(\implies\) mureinová stěna)
- N-neuraminová neboli sialová kyselina, často se vyskytuje na glykoproteinech zvnějšku plasmatické membrány, podílí se na jejím záporném náboji
- monosacharidy mohou reagovat s alkoholy za vzniku glykosidů
- methyl-α-glukosid a mehtyl-β-glukosid
- glykosidická vazba je zodpovědná za spojovnání monosacharidových podjednotek do disacharidů, oligosacharidů, polysacharidů
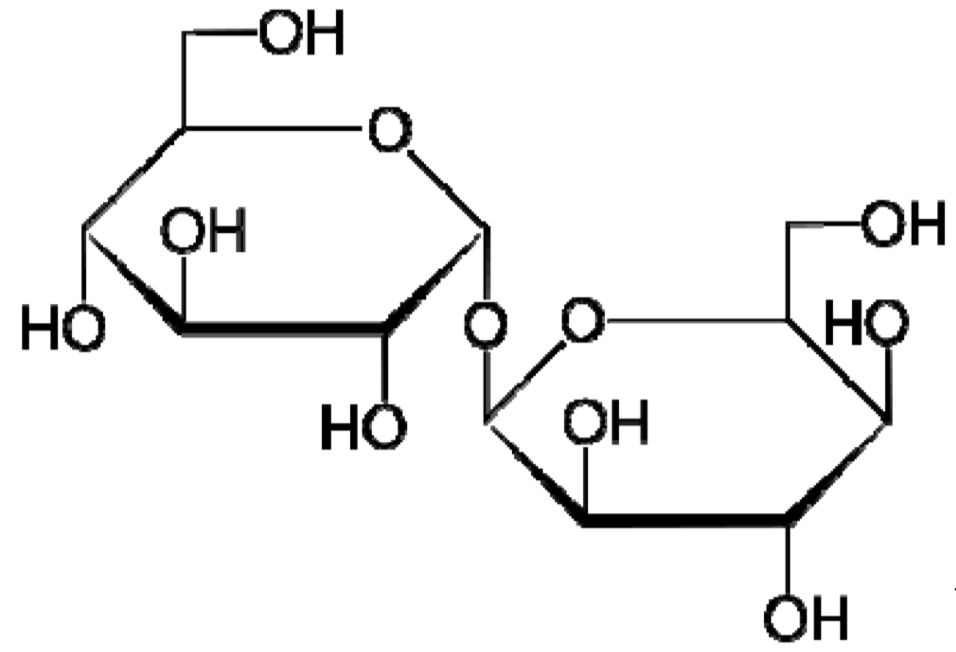
Disacharidy
- Redukující a neredukující disacharidy
- Redukující mají volnou aldo či keto skupinu. Anomerní uhlíky—ty z keto či aminoskupiny—jsou jako jediné schopné redukovat a u neredukujících disacharidů jsou navzájem vázané glykosidickou vazbou.
- podjednotky jsou spojené glykosidickou vazbou
- příklady
- sacharóza se skládá z glukózy a fruktózy spojených α1\(\rightarrow\)2 glykosidickou vazbou
- laktóza, mléčný cukr, z glukózy a galaktózy propojených β1\(\rightarrow\)4 glykosidickou vazbou
- ostatní ze dvou glukóz, různě propojených
- způsob propojení má zásadní podíl na vlastnostech vzniklé látky
- redukující disacharidy mají glykosidickou vazbu 1\(\rightarrow\)4 nebo 1\(\rightarrow\)6 (např. laktóza, maltóza)
- neredukující disacharidy mají glykosidickou vazbu 1\(\rightarrow\)1, nebo 1\(\rightarrow\)2 a jsou tak obsazeny obě poloacetalové
\(\ce{OH}\) skupiny
- důležitý pro odolnost organismu vůči mrazovému stresu napříč organismy od kvasinek po obratlovce
- účastní se anabiózy
- má kryoprotektivní účinky
- vyskytuje se i v krvi některých bezobratlých místo glukózy
Polysacharidy
- Homopolysacharidy a heteropolysacharidy
- Homopolysacharidy se skládají ze stejných podjednotek, heteropolysacharidy z různých. Příkladem homopolysacharidu je celulóza (glukóza, β1\(\rightarrow\)4) a chitin (N-acetyl-glukosamin, β1\(\rightarrow\)4).
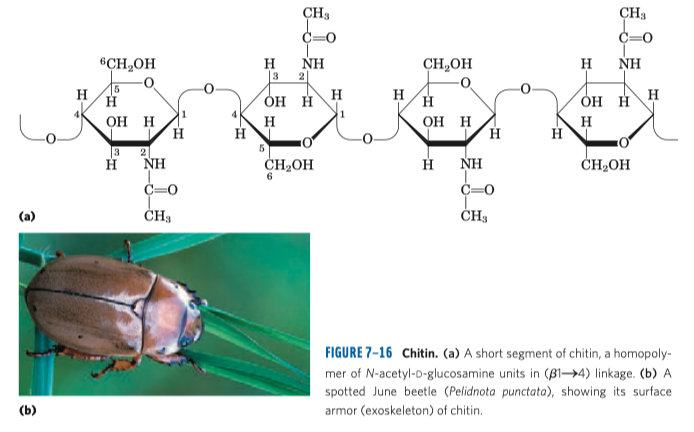
- celulóza, chitin
- pevnost těchto stavebních polysacharidů je dána jejich prostorovým uspořádáním, např. celulóza vytváří fibrily o mnoha tisících podjednotek (sousední paralelní vlákna jsou posunuta o polovinu, jako cihly na zdi)
- maximální propojení vodíkovými můstky v rovině i nad sebou v prostoru, maximalní využití Van der Waalsových interakcí
- ve stěnách rostlin navíc není samostatně, ale mohou tam být další látky, např. lignin, které dohromady tvoří kompozitní strukturu jako např. železobeton
- tunika pláštěnců je také z celulózy
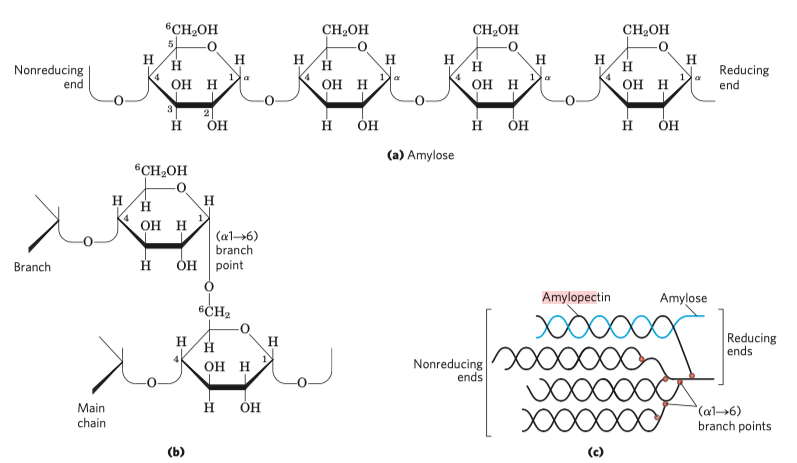
- např. škrob u rostlin, glykogen u živočichů
- škrob se vyskytuje ve 2 formách, amylóza a amylopektin
- glukózy, α1\(\rightarrow\)4
- 20% je tvořeno amylózou jejíž helixy nejsou příliš pevné
- 80% je tořeno amylopektinem, po cca 24–30 jednotkách se větví
- \(\implies\) mnoho neredukčních konců \(\implies\) rychlejší odbourávání (probíhá právě od těch neredukčních konců)
- jen jeden redukující konec
Glykosaminoglykany
Příklad heteropolysacharidů.
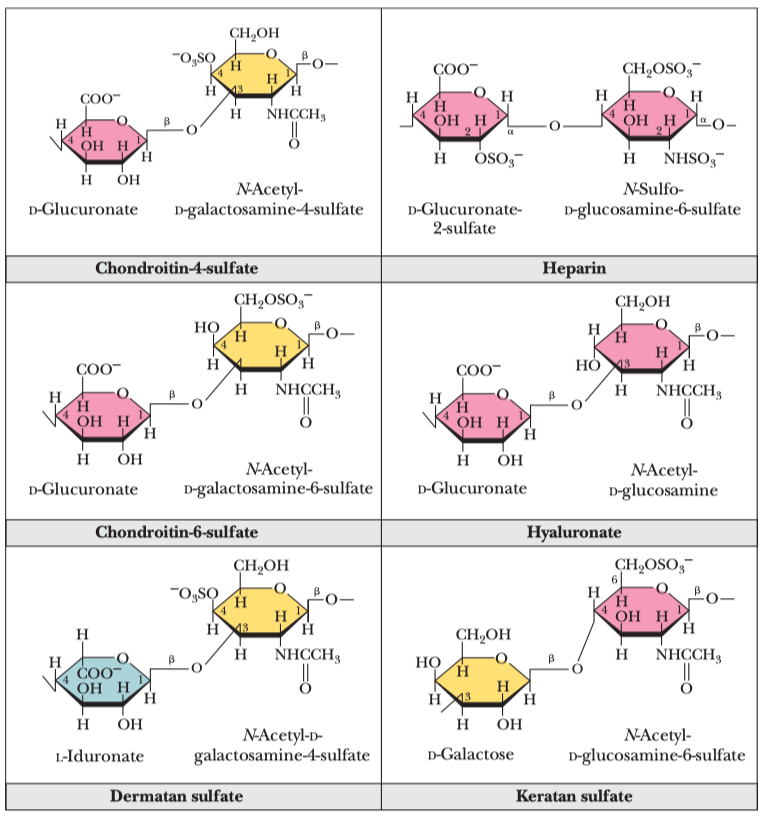
- na prvním místě je sacharid, na druhém je amino sacharid a alespoň jeden z nich obsahuje zápornou sulfátovou nebo karboxylátovou skupinu
- jsou jednou z nejdůležitějších složek mezibuněčné hmoty živočichů a jsou i složkou proteoglykanů
- mají v mezibuněčné hmotě funkci mechanickou (působí jako tlumiče nárazů na tkáně)
- často se jmenují podle místa výskytu, napříkald chondroitin-sulfát v chrupavce, dermatan-sulfát v dermis, keratan-sulfát v rohovině
- hyaluronát je v celé mezibuněčné hmotě
- jsou schopny se hydratovat či dehydratovat: umí vázat velké množství
\(\ce{Na^2+}\) ,\(\ce{K+}\) či\(\ce{Ca^2+}\) iontů a poté (de)hydratací jsou schopné až tisíckrát změnit svůj objem - mají i důležitou signální funkci jako růstové faktory (směrování buněk v embryonálním vývoji, při migraci buněk i v dospělém organismu)
- jsou důležité i pro imunitní systém a nádory, jejich proliferaci
- reakce s antithrombinem, brání srážení krve
- silně záporně nabitý, sulfatovaný, vyskytuje se vlastně jen v žírných buňkách
- podobný je heparansulfát, ten je v endotelu a v mozku
Jsou součástí proteoglykanů.
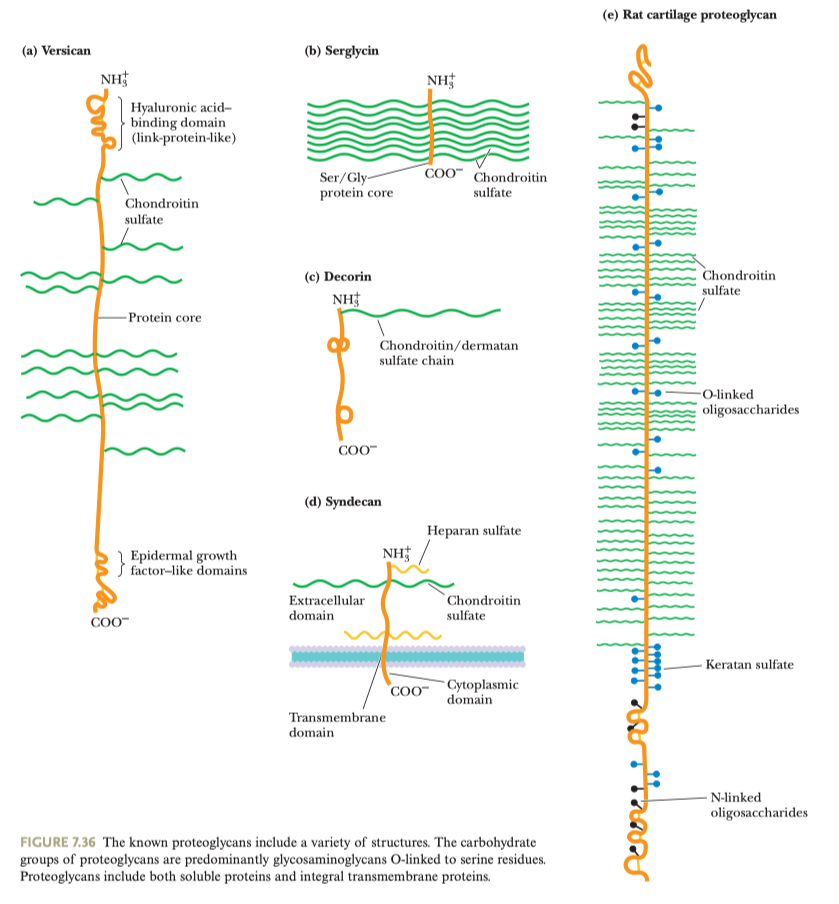
- velké komplexy proteinů a heteropolysacharidů v mezibuněčné hmotě
- jejich struktura se označuje jako kartáčová (viz obrázek)
- páteř tvoří kyselina hyaluronová, na ní jsou vázány Core proteiny a na ně pak řetězce glykosaminoglykanů (často chondroitin-sulfát a keratansulfát)
- core protein na sobě má navázány
\(\ce{N}\) - a\(\ce{O}\) - glykosylované sacharidy a řetězce glykosaminoglykanu
- jen asi 5% proteoglykanů tvoří proteinová složka, 95 % je cukerná
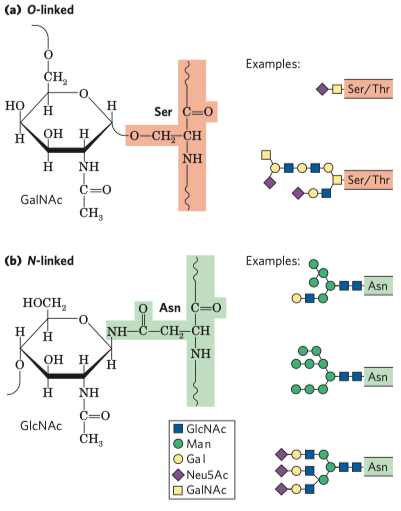
- většina proteinů v těle
- vazba přes N- a O- glykosylaci
- N- je přes
\(\ce{NH}\) skupinu (většinou na Asp)- strukturní komponenty extracelulární matrix (ECM) a buněčných stěn
- účast na signalizaci buněk
- modifikace stability a aktivity proteinů
- podíl na transportu glykoproteinů
- např. u imunoglobulinů
- O- je ta běžná přes
\(\ce{OH}\) (většinou na Ser nebo Thr)- strukturní komponenty ECM a buněčných stěn
- účast na signalizaci buněk
- složka mukózních sekretů
- modifikace stability a aktivity proteinů (může alternovat s fosforylací)
- je také zodpovědná za krevní skupiny a za rozdílnost antigenů
- N- je přes
- glykoproteiny na vnějšku plasmatické membrány jsou modifikovány kyselinou sialovou, která je zodpovědná za jejich záporný náboj
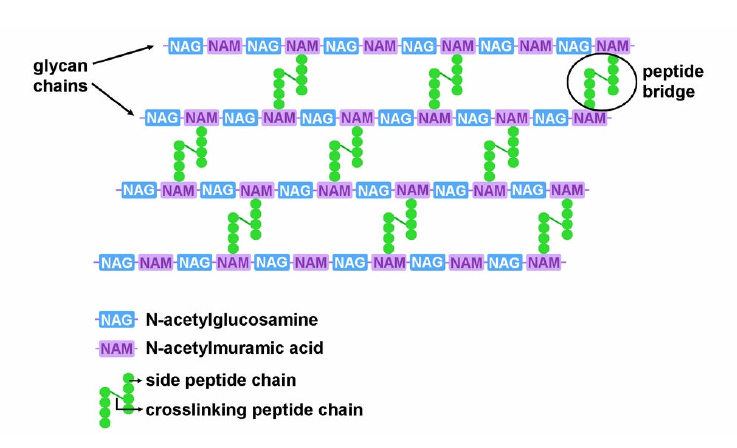
- sacharidy jsou důležité i pro prokaryota \(\implies\) peptidoglykan slouží k tomu, aby pro hostitele bylo obtížnější si jich všimnout
- nachází se ve stěně
\(\ce{G+}\) i\(\ce{G-}\) bakterií - v zásadě se skládá z heteropolysacharidových řetězců navzájem propojených glyciny a krátkým řetězcem AK (např. D-aminokyselinami jako D-alanin)
- u bakterií se vyskytuje také kyselina N-acetylmuramová a N-acetylglukosamin
Glykolýza
- vlastní téměř všem živočichům (kromě pár bakterií)
- zdroj energie
- sestává se z deseti biochemických reakcí, behem kterých se glukóza mění na pyruvát
- další procesy závisejí na prostředí
- za anaerobních podmínek:
- dochází k procesu fermentace = kvašení (mléčné, alkoholové)
- za areobnéch podmínek:
- dochází k aerobní oxidaci v Krebsově (cytrátovém) cyklu a následně k oxidativní fosforylaci
- za anaerobních podmínek:
- Pasteur se domníval, že za kvašení mohou mikroorganismy
- později se zjistilo, že proces probíhá i s mrtvými kvasinkami (díky jejich enzymům)
- na přelomu 19. a 20. století se zjistilo, že se glykolýzy účastní jak enzymy, tak neenzymatické látky
- mechanismus byl ve 40. letech 20. století objasněn
- přípravná
- 5 fází
- přeměna glukózy na dvě zaměnitelné triózy
- výkonná
- 5 fází
- generování ATP (energetický zisk)
- redukce koenzymu NADP
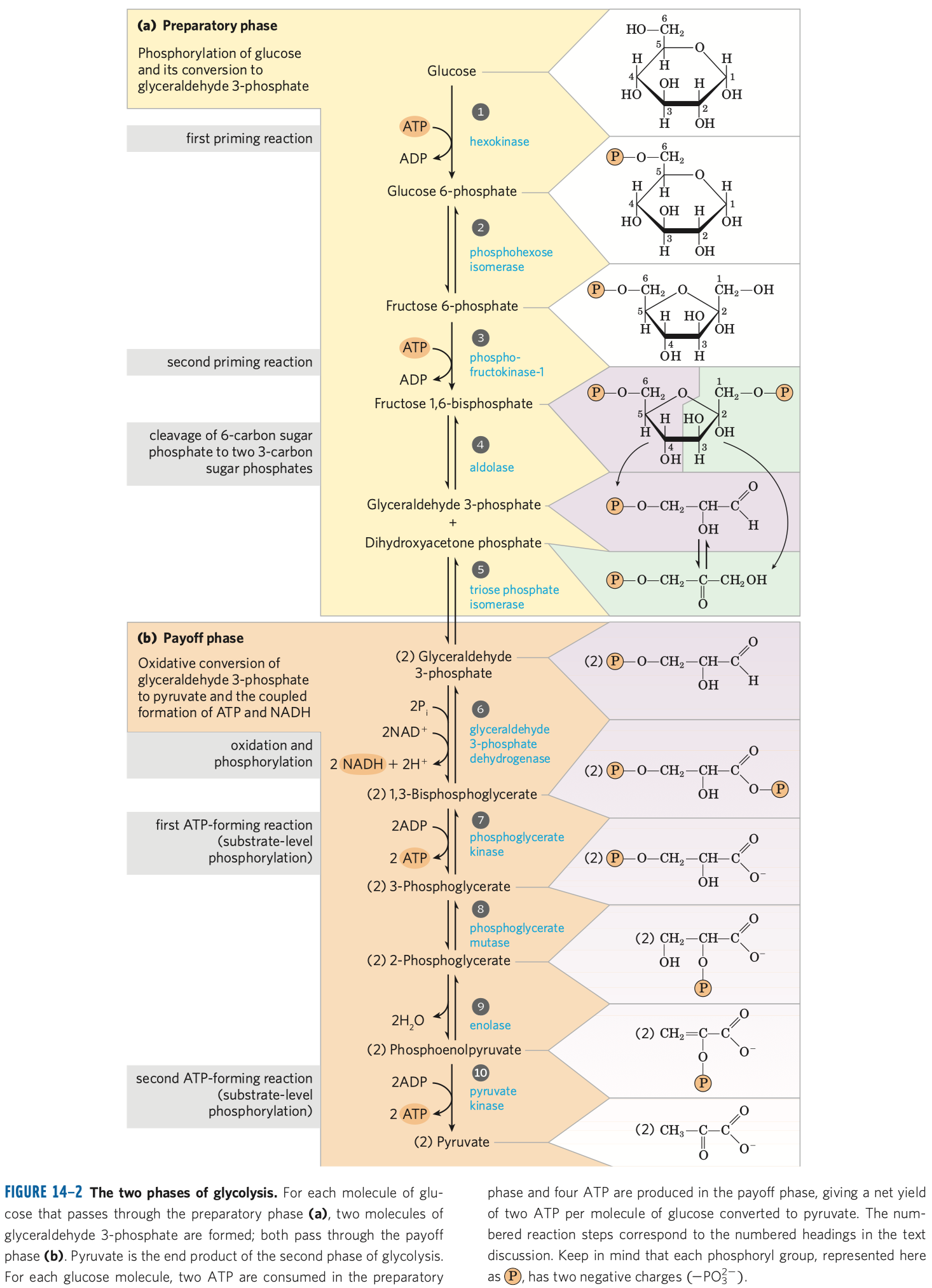
Reakce glykolýzy
První reakce
- jedna z hlavních regulačních reakcí glykolýzy
- ty bývají na začátku (zablokování tvorby meziproduků) a na konci metabolických drah (pro hromadění meziproduktů)
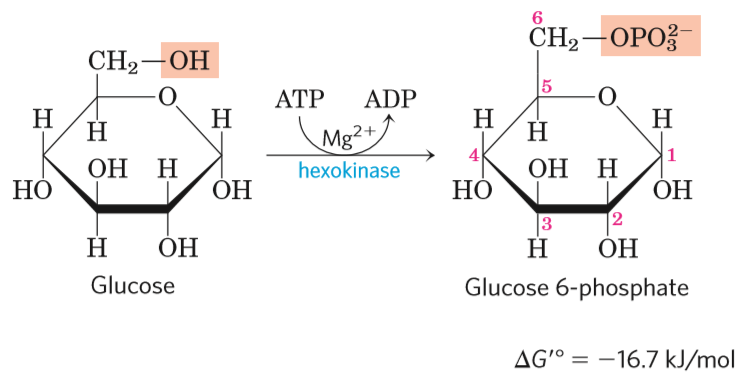
- nespecifický enzym (může katalyzovat celou řadu reakcí)
- katalyzuje první reakci
- kinázy patří mezi transferázy = enzymy přenášející fosfát
- mění glukózu na glukózu-6-fosfát (tzn. přenese fosfát na hexózu)
- hexokináza fosforyluje:
- ve většině tkání glukózu, manózu, ...
- ve slinivce a játrech jen glukózu = glukokináza
- účastní se udržování hladiny glukózy v krvi
- 2 laloky
- glukóza nasedá na katalytické místo mezi laloky
- změna konformace katalytického místa
- uzavření katal. místa mezi laloky
- mimo jiné kvůli vytěsnění vody
- dojde ke změně elektrostatických sil, což umožní vazbu substrátu v konkrétním místě (fosfát by se jinak výrazně jednodušeji navázal na vodu)
- pevné navázání glukózy do buňky
- bez fosforylace může procházet volně přes membránu
- glukóza může být zpracována
- enzym z jaterních buněk
- schopný defosforylace, tj. uvolnění glukózy z buněk
- ve většině tkání není, a tak se tam musí glukóza spotřebovat
- kofaktorem reakcí valné většiny kináz
- stíní náboj na kyslíkových atomech (na β-galaktofosfátu na ATP)
- usnadňují přenos fosfátové skupiny
Druhá reakce
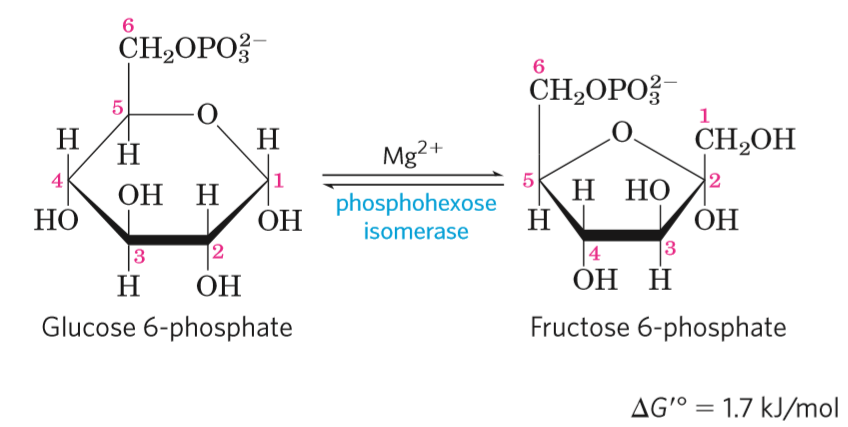
- izomerizace glukóza-6-fosfátu na fruktóza-6-fosfát (aldosa na ketosu)
- katalyzováná glukóza-fosfát-izomerázou
- přípravná reakce
- fruktóza je lépe štěpitelná
- stereospecifická reakce
- acidobazická reakce
- otevření šestičetného cyklu kyselinou, zavření pětičetného bází
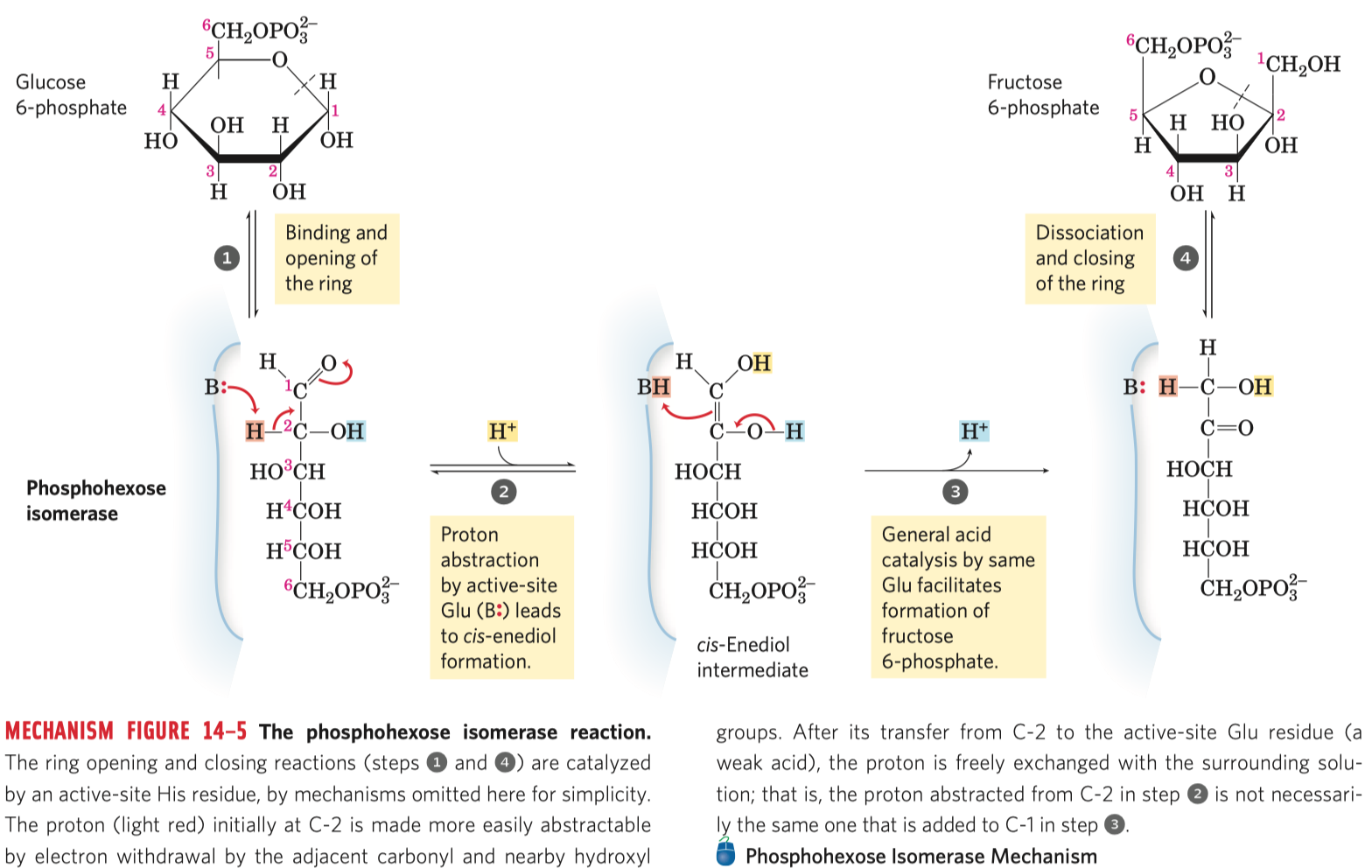
- Stereospecifická reakce
- Reakce, jejíž stereochemický výstup je dán konfigurací výchozích látek—dává různé stereoizomery produktů pro různé stereoizomery reaktantů, nebo s určitými stereoizomery reaktantů vůbec nereaguje.
Třetí reakce
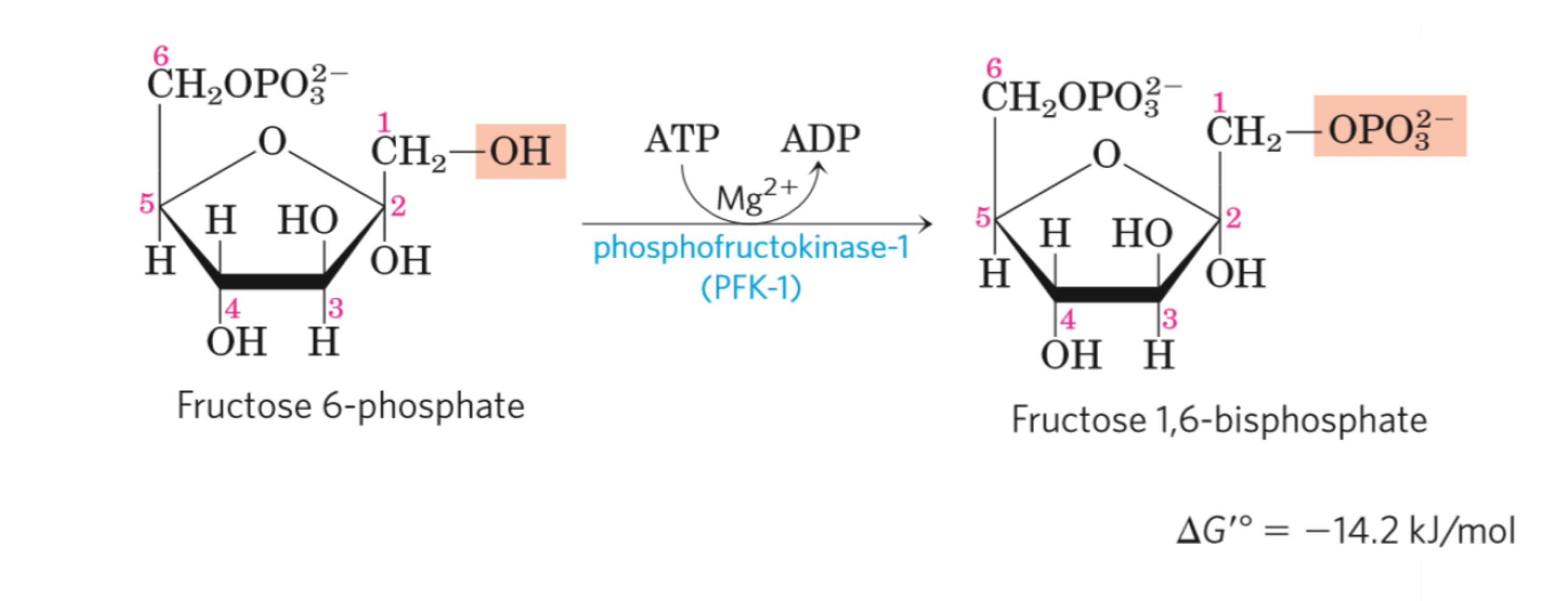
- fosforylace fruktóza-6-fosfátu na fruktózu-1,6-bisfosfát (dále jen F16BP)
- nejdůležitější regulační reakce glykolýzy
- inhibována ATP (značí dostatek energie v buňce) a citrátem
- stimulována AMP (značí nedostatek energie v buňce)
- katalyzována fosfofruktokinázou
- fosforyluje fruktóza-6-fosfát
- znovu dochází k uzavření aktivního místa a vytěsnění vody
- kofaktor: hořečnaté ionty
Čtvrtá reakce
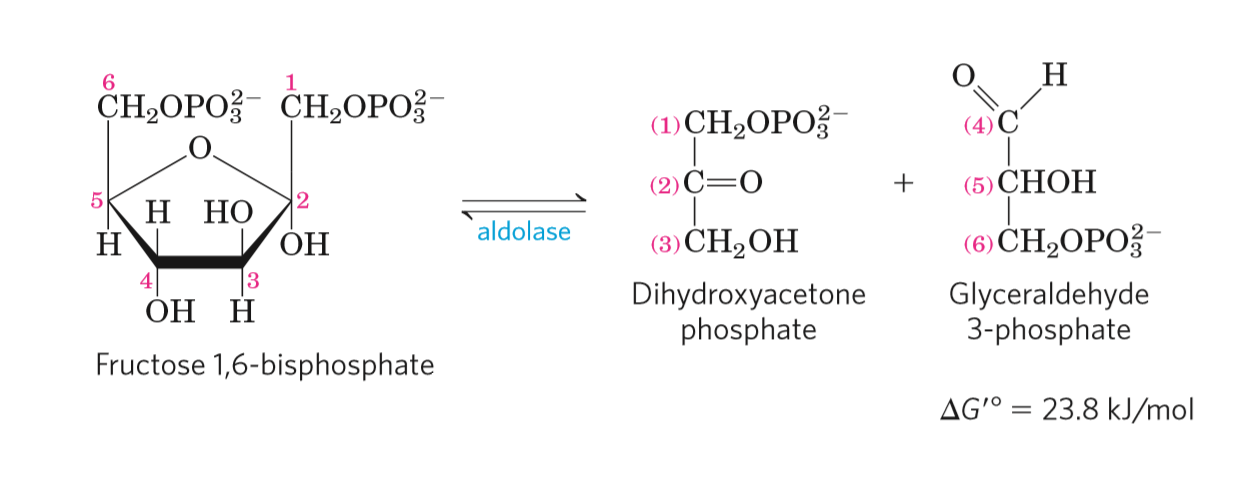
F16BP je štěpena na 2 triózy:- glyceraldehyd-3-fosfát
- dihydroxyacetonfosfát
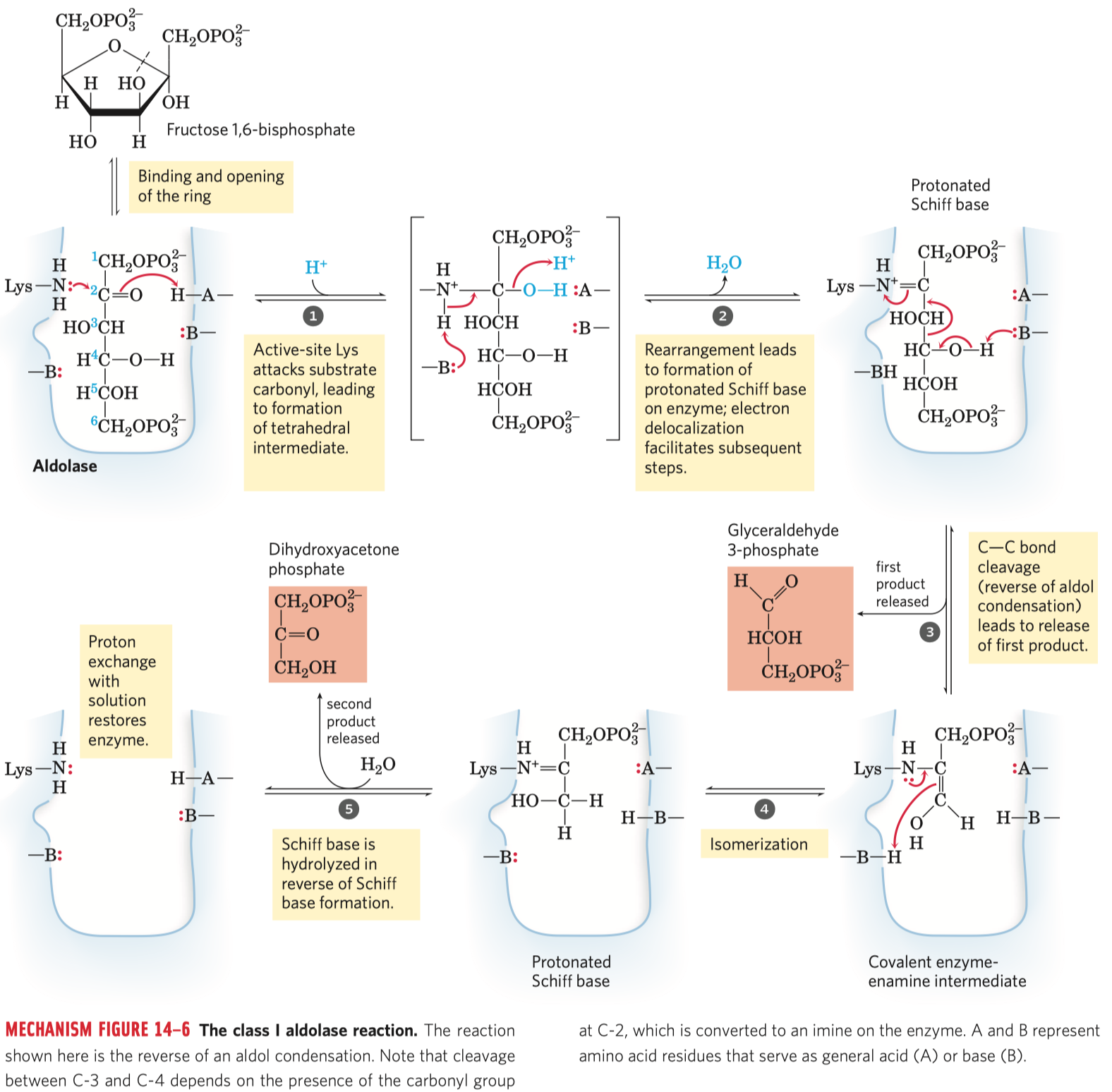
- aldolázová reakce
- katalyzována aldolázou (Schiffova báze)
- dochází k aldolovému štěpení
- štěpení C-C vazeb (obtížné)
F16BP spolu s aktivním centrem enzymu vytvářín tzv. protonovanou Schiffovu bázi, v důsledku toho se delokalizují elektrony a je usnadněno štěpení C-C vazby
- důležitá přítomnost karbonylové skupiny na C(2) a hydroxylové skupiny na C(4)
- dvě třídy aldoláz
- Schiffova báze
- zinečnaté kationty
- některé plísně
- využití: vývoj plísňových inhibitorů
Pátá reakce
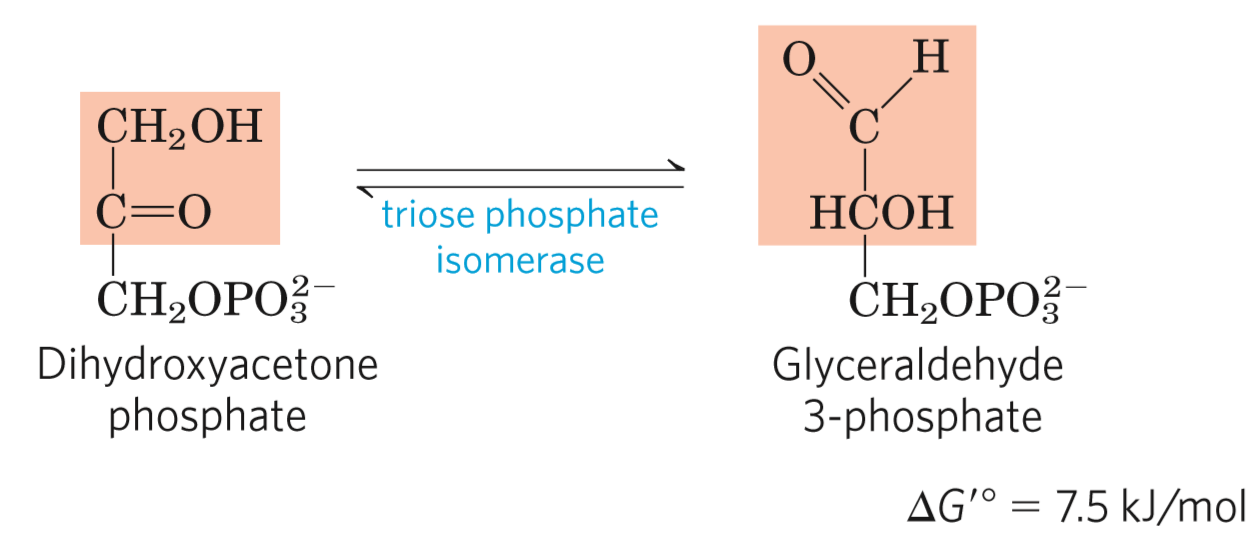
- poslední z přípravné fáze
- reakce enzymu trióza-fosfát-izomerázy
- schopný vzájemně izomerizovat vzniklé triózy (z minulé reakce)
- α-β barel z osmi β-listů ukotvených osmi α-helixy (častá struktura enzymů)
- uvnitř soudku je katalytické centrum
- uzavíratelný
- dokonalý enzym
- rychlost reakce limitována pouze rychlostí srážky enzymu a substrátu
- acidobazická katalýza
- vzniká endiolový meziprodukt
- funguje v obou směrech
Šestá reakce
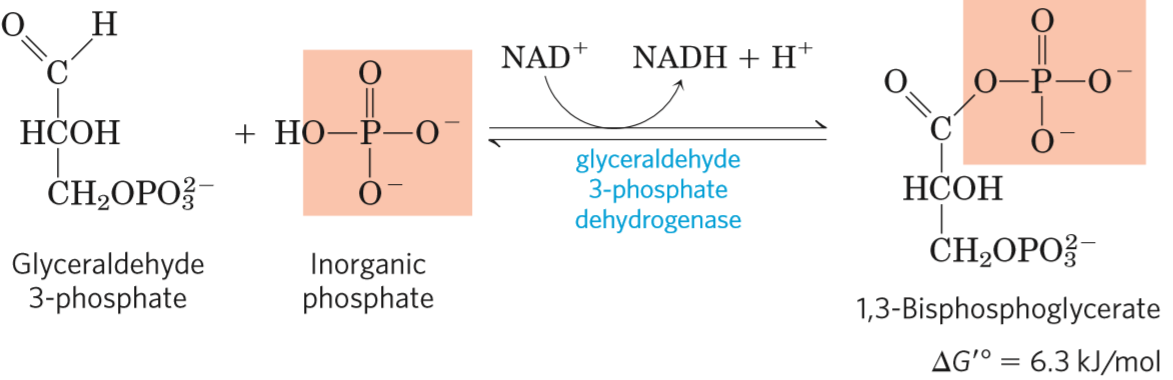
- katalyzována glyceraldehyd-3-fosfátdehydrogenázou
- dochází k uskladnění chemické energie, která je využitelná pro další reakce a tvorbu ATP
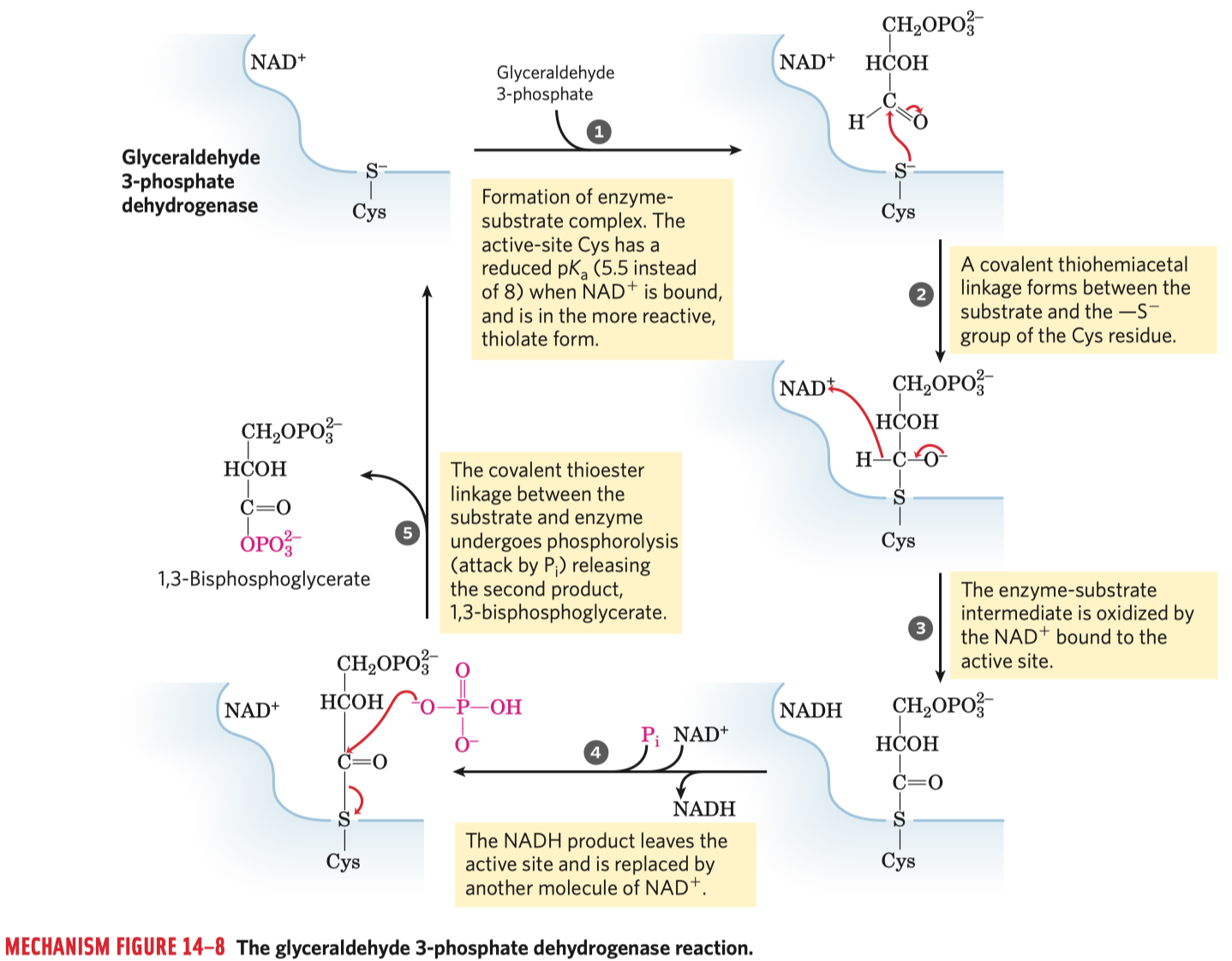
- glyceraldehyd-3-fosfát interaguje s
\(\ce{SH}\) skupinou v aktivním centru enzymu a vzniká thiohemiacetál - oxidace thiohemiacetálu pomocí oxidovaného koenzymu
\(\ce{NAD+}\) na acylthioester (karboxylová kyselina) - uvolňuje se energie, s její pomocí dojde k zabudování anorganického fosfátu z prostředí do glyceraldehyd-3-fosfátu za vzniku 1,3-bisfosfoglycerové kyseliny
- tato energie bude využita v následující reakci k tvorbě ATP
Glyceraldehyd-3-fosfátdehydrogenáza se tak vyskytuje na všech možných místech, kde je potřeba energie, např. ve spermiích.
1,3-bisfosfoglycerát snižuje afinitu hemoglobinu pro kyslík. Proto:
- mutace v hexokináze:
- bude vznikat méně 2,3-bisfosfoglycerátu
- větší afinita ke kyslíku
- defekt v pyruvát-kináze:
- bude se hromadit 1,3-bisfosfoglycerát
- nižší afinita ke kyslíku
Sedmá reakce
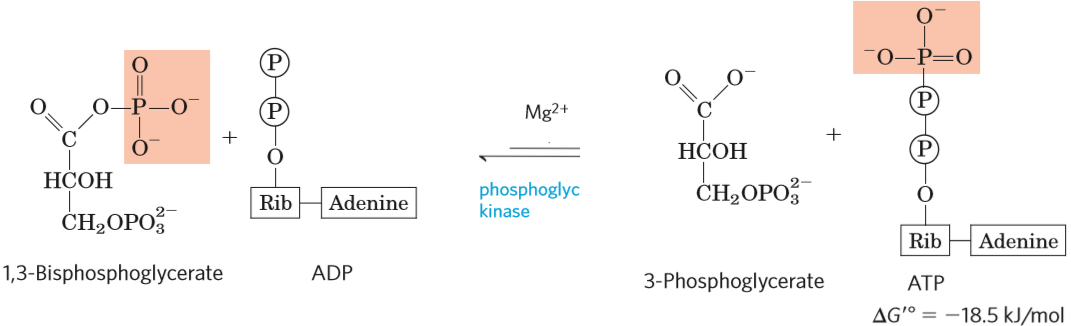
- katalyzována fosfoglycerátkinázou
- mění 1,3-bisfosfoglycerát na 3-fosfoglycerát
- tvorba ATP
- kofaktorem jsou hořčíkové kationty
- k tvorbě ATP je zde využit anorganický fosfát zabudovaný v šesté reakci
- v této reakci vzniká jedna molekula ATP na jednu molekulu glyceraldehyd-3-fosfátu, ale z původní glukózy jsou to celkem 2 molekuly ATP (z jedné glukózy se získají dvě triózy)
Osmá reakce
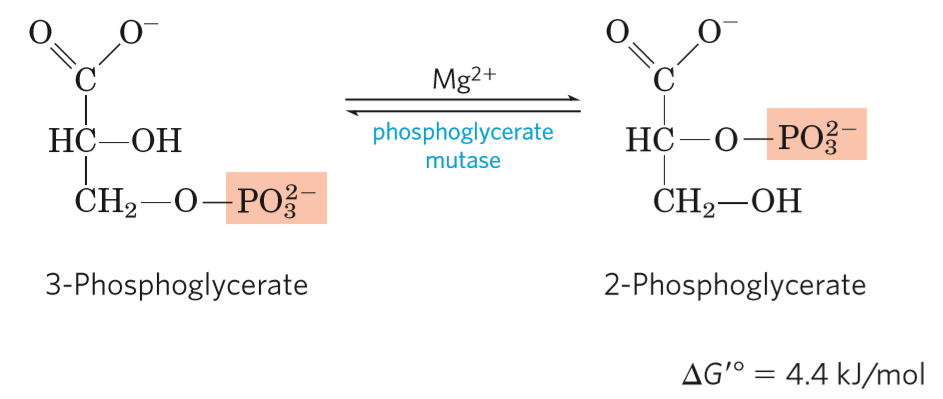
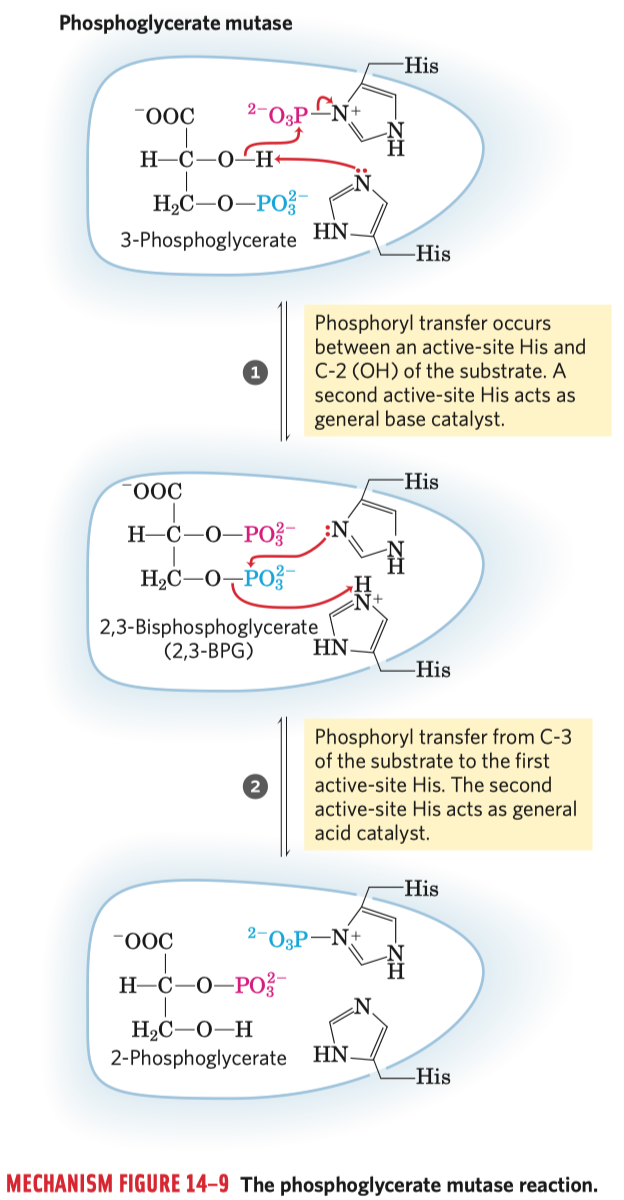
- přípravná reakce (ale ne v přípravné fázy glykolýzy)
- katalyzována fosfoglycerátmutázou
- přeměnu 3-fosfoglycerátu na 2-fosfoglycerát
- přes meziprodukt 2,3-bisfosfoglycerát
- v katalytickém centru AK je histidin, který předává fosfát na druhý uhlík a následně je prohodí
Devátá reakce
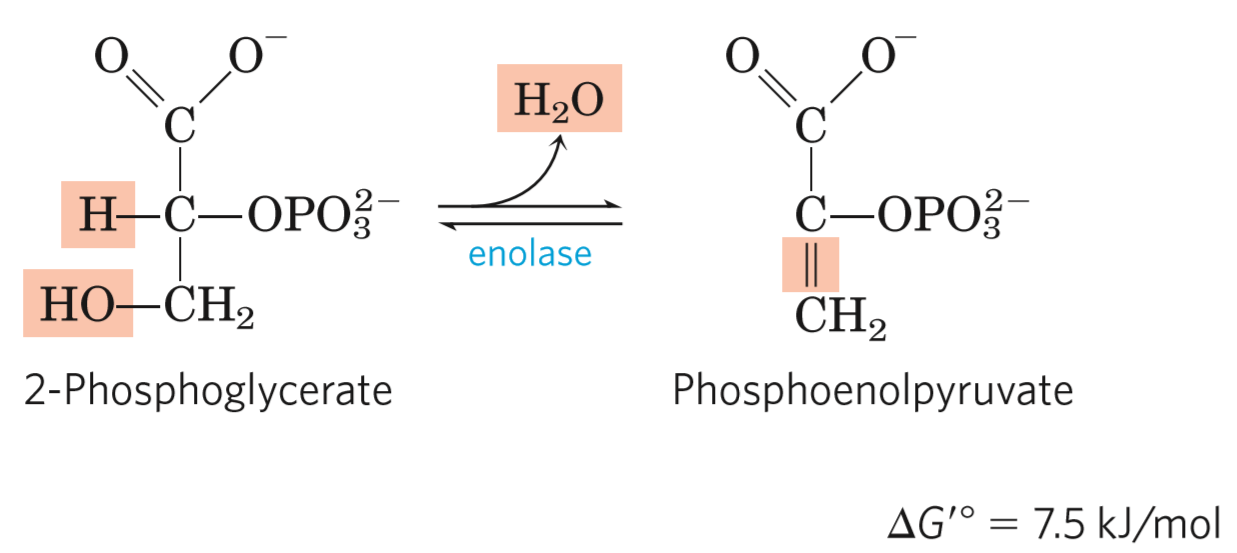
- enolázová reakce
- katalyzována enolázou
- 2-fosfoglycerát se mění na fosfoenolpyruvát
- dehydrogenace
- v první fázi dojde k odštěpení vodíkového protonu
- v druhé fázi k odštěpení hydroxylové skupiny
- vzniká makroergní sloučenina fosfoenolpyruvát
- ta bude v poslední reakci opět využita ke tvorbě ATP
Desátá reakce
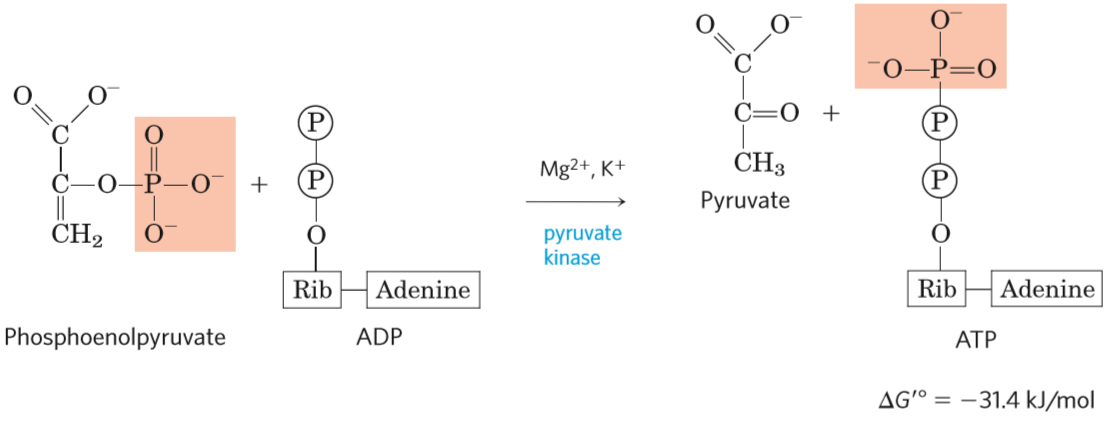
- katalyzuje pyruvátkináza
- kofaktory: Mg a K kationt (stabilizace meziproduktu)
- tvorba ATP za využití energie z fosfoenolpyruvátu vzniklém v předchozím kroku
- fosfoenolpyruvát \(\rightarrow\) enolpyruvát \(\rightarrow\) pyruvát
- enolpyruvát tutomerizován na pyruvát
- vysoká změna energie, ta je využita k syntéze ATP
- enolpyruvát tutomerizován na pyruvát
- na jednu molekulu glukózy další 2 molekuly ATP
Zpracování pyruvátu za anaerobních podmínek
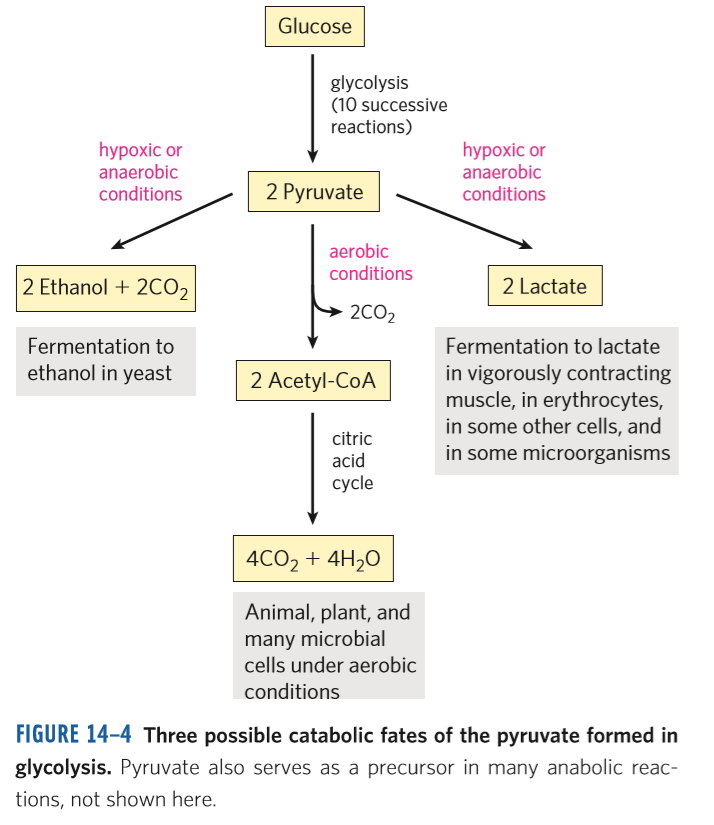
- po glykolýze v anaerobních podmínkách dochází k fermentaci
- jejím hlavním účelem je reoxidace koenzymu
\(\ce{NADH}\) na\(\ce{NAD+}\) \(\ce{NAD+}\) je potřeba pro glyceraldehyd-3-fosfát dehydrogenázovou reakci
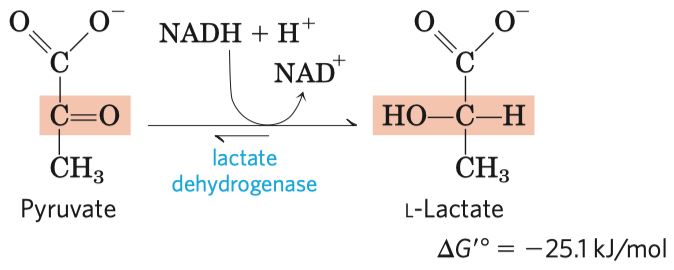
- pyruvát se mění na laktát
- dochází k reoxidaci
\(\ce{NADH}\)
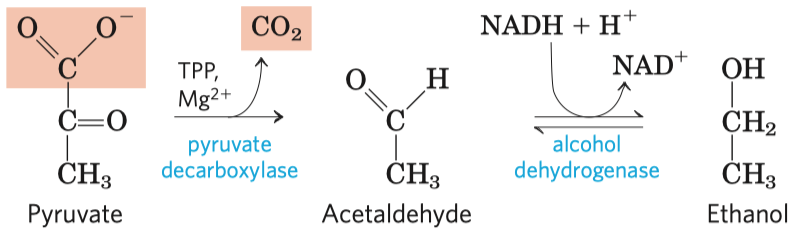
- má dva kroky (viz obrázek), prochází před meziprodukt acetaldehyd
- důležitým kofaktorem té první reakce je
TPP - obecně se účastní dekarboxylací v buňce (např. dekarboxylací AK, proto thiamin patří mezi vitamíny řady B)
- při druhé reakci dochází k reoxidaci, jako kofaktor zde slouží zinek
Regulace glykolýzy
- lokální a globální
- pomocí hormonů
- geneticky
- ovlivněním exprese
- alostericky
- pomocí alosterických inhibitorů a aktivátorů
- posttranslačními modifikacemi
- fosforylací
Většina glykolytických enzymů navíc potřebuje kofaktory (u všech kináz jsou to ionty
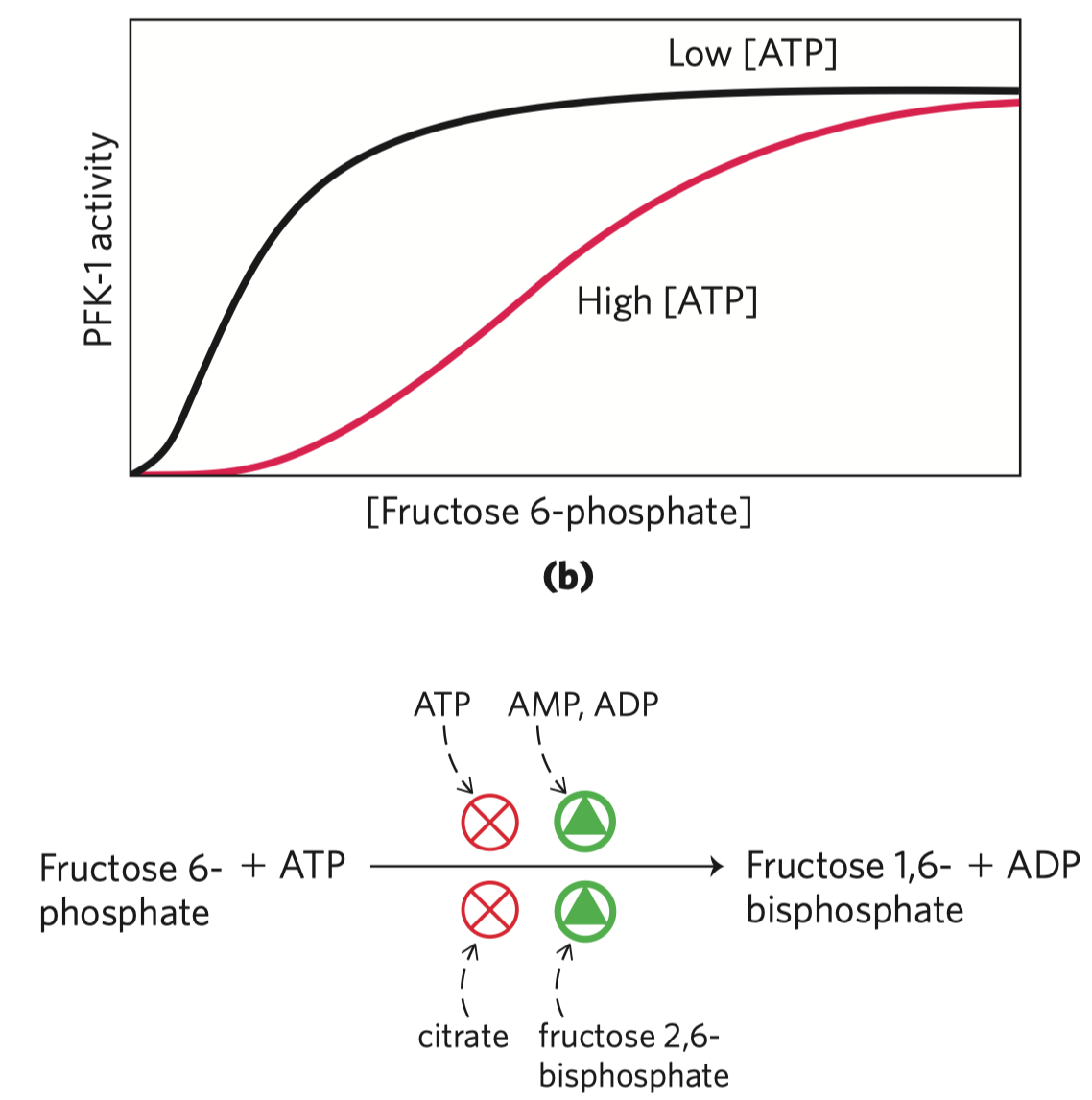
- do glykolýzy mohou vstupovat i jiné substráty, než glukóza
- například fruktóza-6-fosfát ve svalových a jaterních buňkách
- hexokináza ve svalech schopná fosforylovat jak glukózu, tak fruktózu
- v jaterních buňkách není, jsou tam specifické enzymy fosfoglukokináza a fosfofruktokináza
- galaktósa-1-fosfát \(\rightarrow\) glukóza-6-fosfát
- manóza \(\rightarrow\) manóza-6-fosfát \(\rightarrow\) fruktóza-6-fosfát
- například fruktóza-6-fosfát ve svalových a jaterních buňkách
- glykolytické enzymy mají i signální funkce
- hexokináza
- regulace transkripce
- glyceraldehyd
- vazba
\(\ce{NAD+}\) - replikace
- transkripce
- vazba
- hexokináza
- nádorové buňky používají glykolýzu i za anaerobních podmínek, čímž tvoří kyselé vnější prostředí
Cyklus kyseliny citronové
- má mnoho jmen
- cyklus kyseliny citronové (CKC)
- tak jej nazval objevitel
- cyklus trikarboxylových kyselin
- kyselina citrónová byla zpochybněna jako intermediát cyklu
- vědělo se ale, že tam je nějaká trikarboxylová kyselina
- Krebsův cyklus
- podle objevitele (pozn. redaktora viz níže)
- cyklus kyseliny citronové (CKC)
- tlustou svislou čarou je vyznačena glykolýza, končí na pyruvátu (kyselině pyrohroznové)
- pyruvát vstupuje do velkého množství reakcí, např. mléčného kvašení, laktátdehydrogenázové reakce a alkoholového kvašení, většinou však přes další molekulu vstupuje právě do CKC
Na pyruvátu a dalších molekulách se dá demonstrovat vlastnost katabolismu, který využívá energeticky bohaté sloučeniny z potravy na ATP a zisk buněčné energie.
- proteiny, lipidy, sacharidy
- získáváme je zvenčí, v organismu jsou poté degradovány—všechny tyto vysoce rozdílné molekuly se v rámci katabolismu sjednotí a setkají se v jedné univerzální molekule, acetyl koenzymu A (acetyl-CoA)
- acetyl-CoA je univerzální přenašeč acylových skupin (
\(\ce{COOH}\) po odtržení\(\ce{OH}\) ) - acetyl-CoA je také přenašeč acetylové skupiny (
\(\ce{CH3CO}\) )
- acetyl-CoA je univerzální přenašeč acylových skupin (
Jak KC vznikl? Dráha (někdy neúplná) probíhá v některých bakteriích, část i obráceně (slouží k redukci).
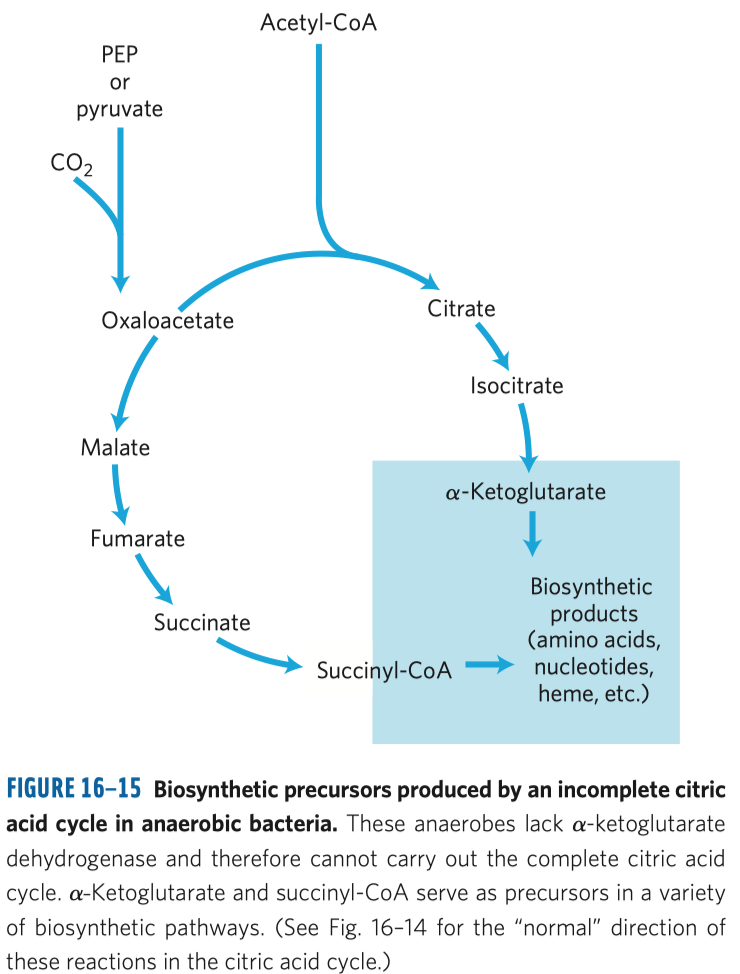
Celá dráha kromě zpracování acetyl-CoA a uvolnění NADH tvoří také různé intermediáty, které jsou užitečné pro syntézy.
Některé AK se na acetyl-CoA nemění; vždy ale dochází k oxidaci (přenos elektronů), což zařizuje glyceraldehydfosfát-dehydrogenáza. Vzniká NADH, který je poté někdy použit v
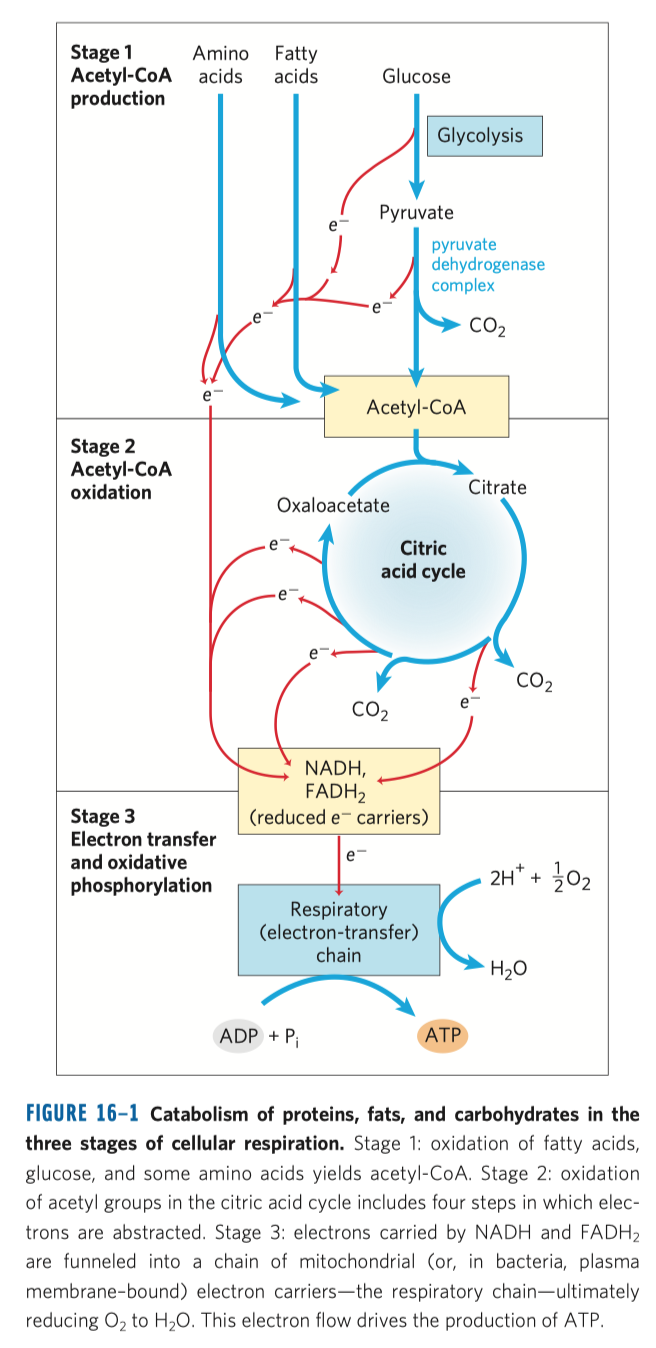
- konvergující dráhy vedoucí k acetyl-CoA
- glykolýza, β-oxidace mastných kyselin, rozštěpení na dvě triózy
- Krebsův cyklus
- oxidativní fosforylace
- z různých látek vznikne jen několik produktů
- energetické molekuly směřují k acetyl-CoA
- pak je cyklus trikarboxylových kyselin, z nich se tvoří molekula GTP (nebo ATP), dvě molekuly
\(\ce{CO2}\) a redukované koenzymy- na jednu molekulu glukózy vznikají redukované koenzymy na šesti místech a všechny nesou vysokoenergetické elektrony, které odejmuli při oxidačních reakcích
- energie může být využita k syntéze ATP oxidací těchto koenzymů
- vstupuje dvojuhlíkatý (C2) acetyl-CoA a s C4 oxalacetátem tvoří C6
- ta je ve sledu sedmi reakcí dvakrát dekarboxylována, uvolní se dvě molekuly
\(\ce{CO2}\) (co je většina toho\(\ce{CO2}\) , který vydechujeme) - dva uhlíky se uvolní během cyklického pochodu
- další uvolňované molekuly jsou čtyři redukované koenzymy
- jako bonus vzniká jedna molekula makroergního fosfátu (např. GTP, ale to záleží na organismu)
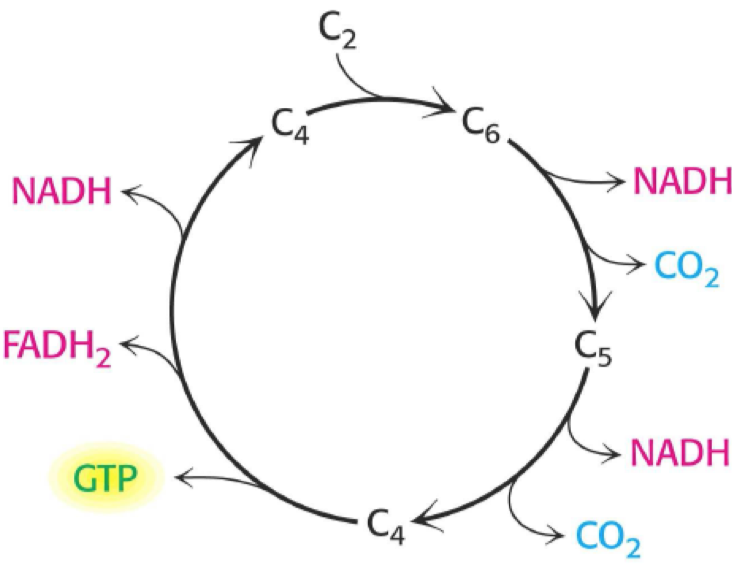
Přípravná reakce
Stará se o přeměnu pyruvátu, který je výstupem glykolýzy, na acetyl-CoA, který potřebujeme v KC. Účastní se jí komplex pyruvát dehydrogenázy (PDC).
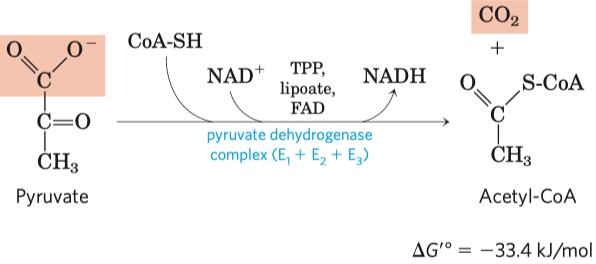
- oxidativní dekarboxyklace, ztratí se jeden
\(\ce{CO2}\) a dva elektrony - průběh reakce není tak jednoduchý jak by napovídal obrázek, pyruvát-dehydrogenázový enzym je komplex enzymů E1, E2, E3 a pěti koenzymů
- změna volné energie je silně záporná, acetyl-CoA je tedy makroergní sloučenina
Struktura PDC
- E1 katalyzuje oxidativní dekarboxylaci pyruvátu
- pevně váže koenzym
TPP
- pevně váže koenzym
- E2 (dihydrolipoyl-transacetyláza) katalyzuje přenos acetylové skupiny vzniklé v první reakci na CoA
- pevně váže koenzym kyselinu lipoovou, která je vázána na amidovou skupinu (proto se jmenuje lipoamid)
- volně váže CoA, který pro E2 funguje jako substrát
- E3 (dihydrolipoyl-dehydrogenáza) regeneruje oxidovanou formu lipoamidu
- pevně váže koenzym FAD (flavin-adenin-dinukleotid), na který jdou elektrony
- volně váže koenzym
\(\ce{NAD+}\) (nicotinamid adenin dinukleotid), který pro E3 funguje jako substrát
- v komplexu se u E. coli objevuje 24 krát E1, 24 krát E2 a 12 krát E3, celý komplex má
\(\pu{4500 Da}\)
Přiblížíme si ty pevně vázané a jeden z těch volných.
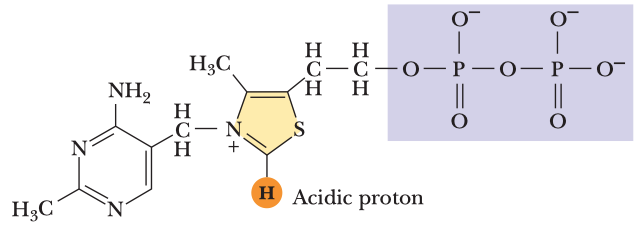
- ze dvou cyklických částí, je tam pyrofosfátová skupina
- vyskytuje se v celé řadě enzymů, kde se přenáší nějaké skupiny, zde přenáší acetylovou
- často se účastní dekarboxylací
- jeho zdrojem je vitamín thiamin (vtiamín B1)
- tělo jej neumí samo syntetizovat, nedostatek vede k nemoci beri-beri
- skládá se z vlastní kyseliny lipoové
- kyselina lipoová může být oxidovaná či redukovaná, protože síra může nést redukující ekvivalenty
- je možná ještě třetí forma—síra může nést acetylovou skupinu
- funguje jako přenašeč, je připojený na molekulu lysinu
- Lys je dlouhý, kys. lipoová také \(\implies\) spolu tvoří dlouhé rameno, které se může pohybovat mezi aktivními místy dvou enzymů
- rameno může v jedné pozici převzít redukční ekvivalenty a acetylovou skupinu, přehoupnout se jinam a tam náklad odevzdat a redukovat se
- někdy se tomu říká lipoyl-lysin
- poměrně veliká molekula, má motiv společný pro mnoho biomolekul
- obsahuje adenin, ribózu, pyrofosfát
- vypadá jako NAD nebo ADP ale je tam ribóza fosforylovaná na C3
- merkapto-ethylamin může tvořit vazbu s acetylovými skupinami (např. v acetyl-CoA)
A dále ještě NAD(H).
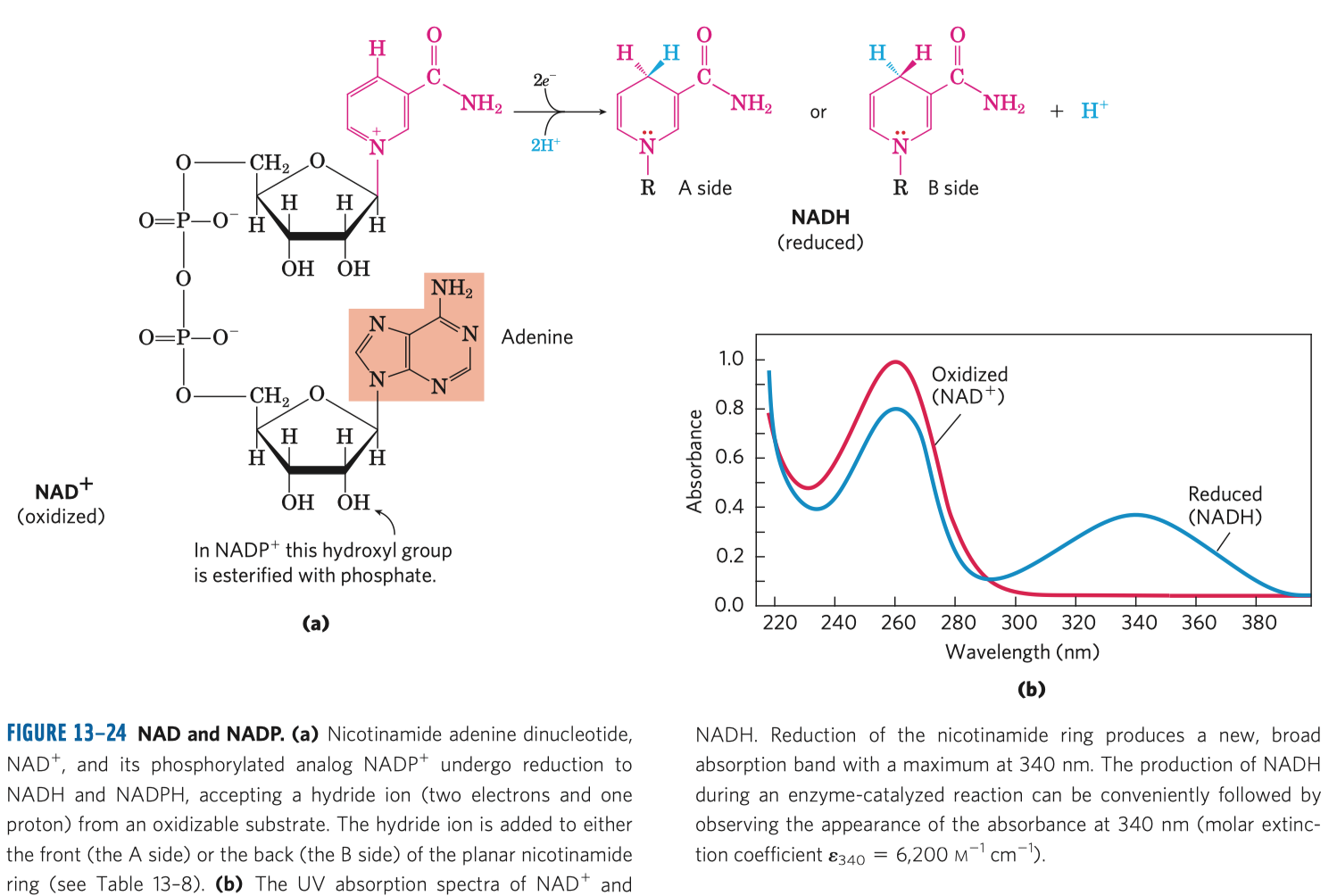
- u E. coli (a dalších prokaryot a
\(\ce{G+}\) bakterií) je organizován do dvou pomyslných krychlí- na vnitřní jsou E2 (8 vrcholů, na každém jsou tři E2, celkem 24)
- na vnější jsou E1 (2 na 12 hranách, tj. 24) a E3 (2 na 6 stěnách, tj. 12)
- dohromady máme 60 podjednotek tvořících PDC
- u lidí a
\(\ce{G-}\) bakterií je to složitější, PDC je organizován do dvou vnořených dvanáctistěnů- jeden vevnitř (20 krát E2), jeden vně (30 krát E1 tetramer na každé hraně, 12 krát E3 dimer na každé stěně)
- celkem 204 podjednotek,
\(\pu{10 MDa}\) - tento komplex je v
mch matrix a všechny proteiny jsou kódovány v jádře \(\implies\) musí se tam nějak dostat a pak se poskládat do dvanáctistěnu- genetické vady ve struktuře/transportu/poskládání jsou letální
Funkce PDC
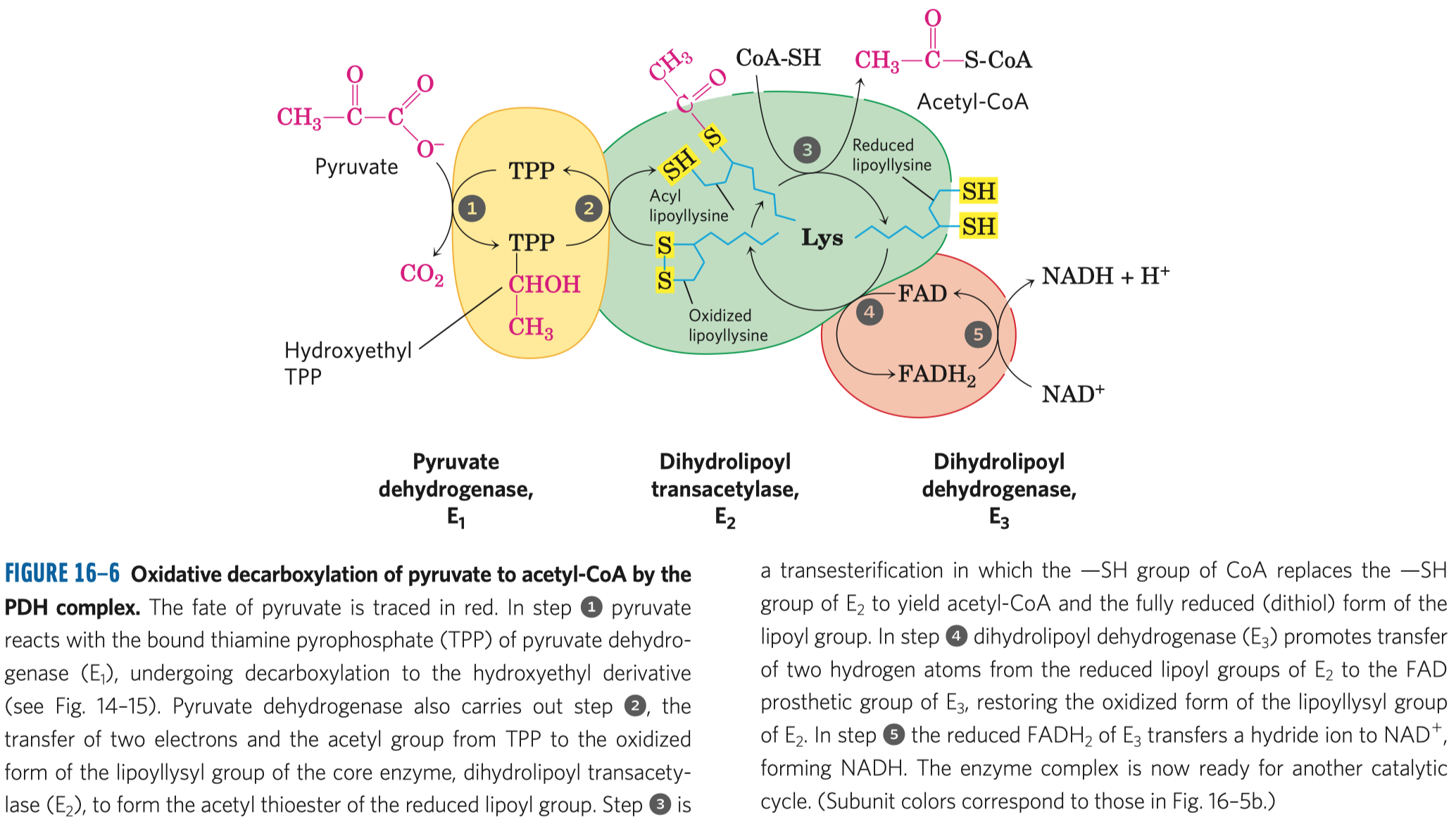
- pyruvát se dekarboxyluje, vzniká acetylová skupina vázající se na
TPP - na lipoamid je přenesena acetylová skupina a je redukována jedna sirná skupina na kyselině lipoové
- acetylová skupina je přenesena na CoA a redukuje se i druhá síra na lipoamidu
- produkty již vznikly, je už jen potřeba vrátit enzym do původního stavu
\(\ce{FAD}\) se redukuje na\(\ce{FADH2}\) , síry na E2 jsou nyní opět oxidovány- vodíky mu dopraví raménko z E2
\(\ce{FADH2}\) předá vodíky\(\ce{NAD+}\) (\(\rightarrow\)\(\ce{NADH + H+}\) ), E3 je nyní v původním stavu\(\ce{NADH + H+}\) předá protony do elektron-transportního řetězce na membráně, kam se k enzymu pevně připoutaný FAD nedostane
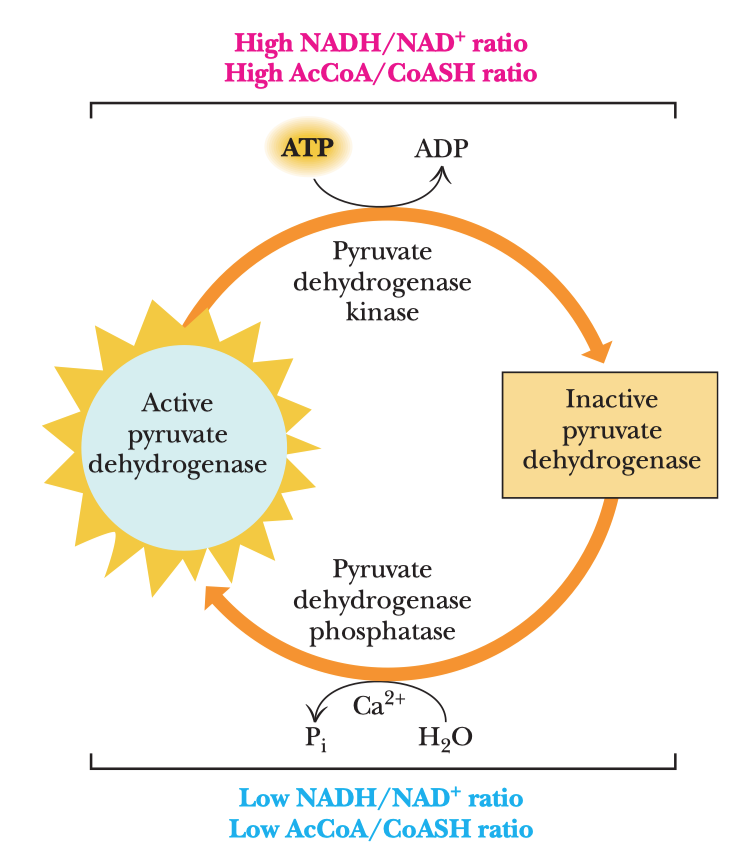
- kromě alosterické regulace je komplex regulován i kovalentními modifikacemi, fosforylací a defosforylací
- jsou na ní Ser či Thr skupiny, kam se může fosfátová skupina vázat
- kináza-pyruvátdehydrogenáza a fosfatázy, které ten fosfát zase odštěpí
- regulace závisí na koncentraci produktuů a reaktantů
- když je nadbytek acetyl-CoA nebo NADH, čili jednoho z produktů, tak je kináza aktivní a PDC brzdí
- když je moc pyruvátu či ADP, tak se kináza inaktivuje a celé se to zrychlí
- kináza je ke komplexu připojena stále
- fosfatáza je aktivována hlavně vápníkem (důležitý druhý posel), připojuje se ke komplexu jen dočasně
- arsen se váže na thiolové skupiny lipoátu, zamezí tím navázání acetylové skupiny a přenos acetátu z prvního enzymu na koenzym A
- tzv. chelatují (obsadí) enzym
- využití arsenu
- jedy
- za války se používal lewisit (sloučenina arsenu), Britové používali british antilewisid
- antilewisid se navázal na lewisid a sloučenina se vyloučila v moči
- léčba (např. syfilis), preantibiotikum
- někteří parazitičtí prvoci (trypanosomy, plasmodia a další,) mají PDC citlivější než my, když se vytitruje správná koncentrace, nás to nezabije, ale je ano
- příklady otravy: Napoleon, kloboučník z Alenky (proto byl šílený), původní fotografové
Odkazy na
Reakce KC
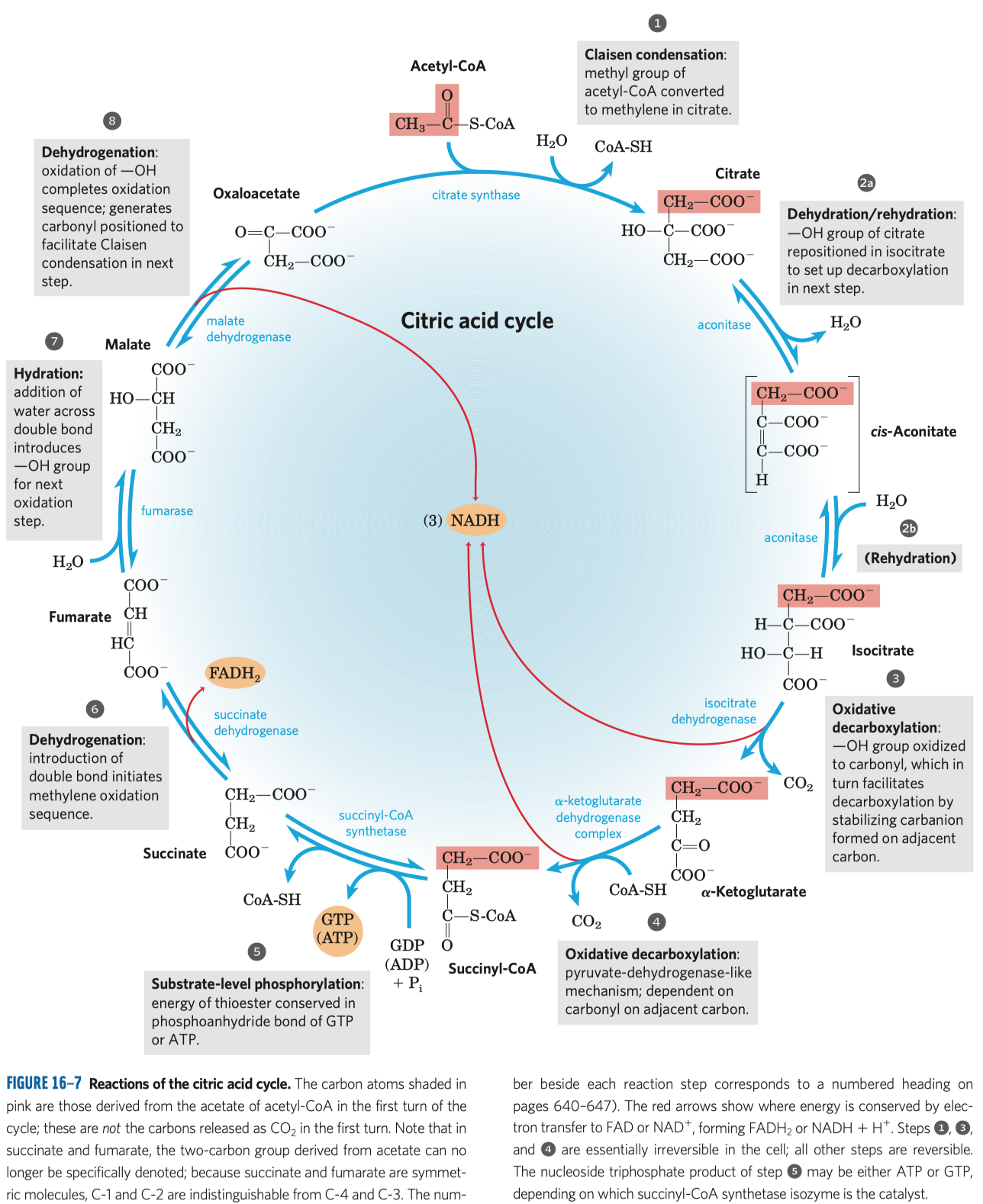
Hlavní průběh (produkty, enzymy, atp.) viz obrázek. Následují pouze poznámky k jednotlivým fázím.
První reakce
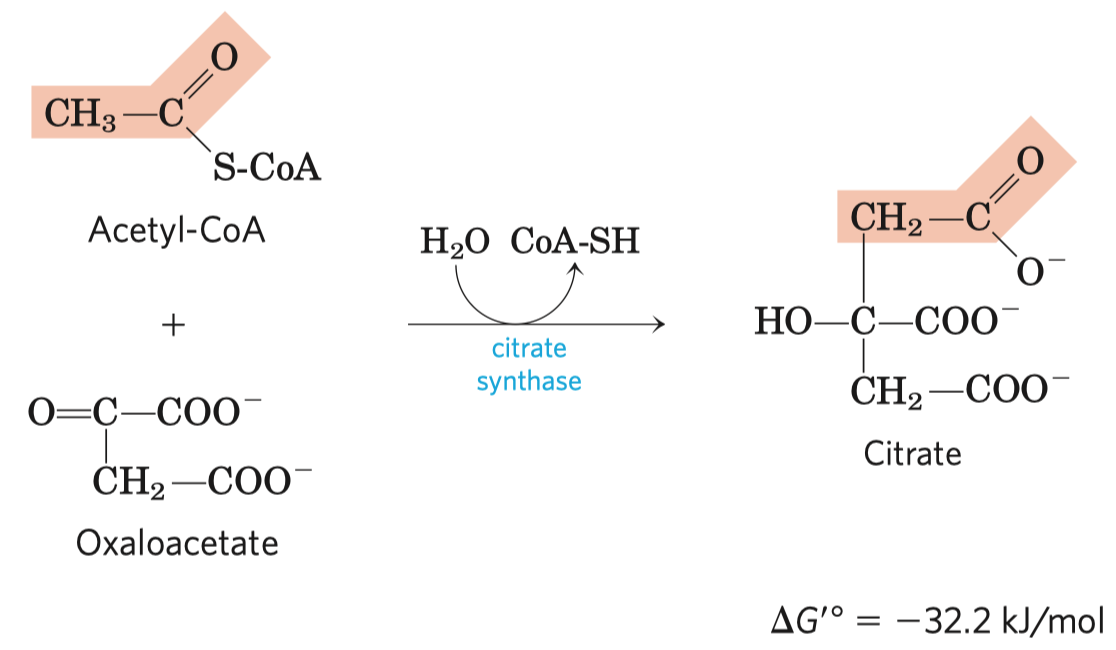
- exergonická
- typický příklad uspořádané enzymatické reakce: na enzym se nejprve naváže oxalacetát a až pak se může navázat acetyl-CoA
- syntáza (ne syntetáza) \(\implies\) nepotřebuje makroergní molekulu
- Prochirální molekuly
- Organické molekuly, které ač nejsou chirální, mají potenciál reagovat asymetricky, pokud se vážou na asymetrická vazebná místa.
- viz obrázek
- citrát je symetrická molekula
- má dvě stejné
\(\ce{COO-}\) skupiny, ze kterých se uhlíky po reakci objeví na dvou různých místech v α-ketoglutarátu - dalo by se čekat, že oba uhlíky z citrátu skončí na obou místech v molekule se stejnou pravděpodobností (symetricky)
- má dvě stejné
- po pokusech s označenými izotopy uhlíku se ale ukázalo, že jeden uhlík vždy skončí na tom prvním a druhý vždy na tom druhém místě
- z toho se vyvodilo, že ať už se na α-ketoglutarát mění cokoli, nic symetrického to není—tedy určitě ne citrát
- proto se měnil název cyklu
- z toho se vyvodilo, že ať už se na α-ketoglutarát mění cokoli, nic symetrického to není—tedy určitě ne citrát
- nakonec se zjistilo, že je to opravdu citrát, ale že se chová prochirálně—na enzymu jsou tři vazebná místa, na která se citrát musí přesně strefit, a to jde pouze jedním způsobem \(\implies\) citrát reaguje asymetricky, přestože je symetrický \(\implies\) konkrétní uhlík vždy skončí na stejném místě
Druhá reakce
- přeměnu sekundárního alkoholu na terciální (přenos hydroxylové skupiny z jednoho uhlíku na druhý)
- molekula izocitrátu je totiž snadněji oxidovatelná (a potažmo i dekarboxylovatelná), než molekula samotného citrátu
- tzv. sebevražedný substrát
- látka sama o sobě inhibující není, až po vstupu do metabolismu se stane jedovatou a inhibuje
- např. některé rostliny jako obranu proti nepřátelům tvoří fluoro-acetát
- fluoro-acetát \(\rightarrow\) fluoro-acetyl-CoA \(\rightarrow\) fluoro-citrát \(\rightarrow\) ireversibilní inhibice akonitázy
- má železosirné jádro
- síra je tam dvojího typu
- organická (v cysteinu), váže se na tři atomy Fe
- anorganická, koordinuje celý komplex
- kromě tří cysteinem vázaných Fe je tam jeden atom nevázaný, ten interaguje s karboxylovou skupinou citrátu a s vodou—tam běží přeměna
- nalezena i v cytoplazmě
- akonitáza v cytoplasmě slouží jako regulátor hladiny železa v cytoplasmě
- velká koncentrace Fe \(\rightarrow\) uvolňování radikálů
- když je Fe hodně, v akonitáze se ukládají 4 atomy
- když je Fe málo, tak se železosirný komplex uvolní a místo vazebného místa pro Fe vznikne vazebné místo pro vlásenku mRNA
- podle toho, o jaké mRNA se jedná, se mění i regulační funkce akonitázy
- mRNA feritinu
- feritin je protein, který zabaluje Fe do zásobních balíků
- když se na mRNA naváže akonitáza, zastaví se translace feritinu
- mRNA transferinu
- transferin nosí železo z okolí buňky dovnitř buňky
- mRNA je akonitázou stabilizována, míra translace se zvýší
- mRNA feritinu
Třetí role akonitázy souvisí s nukleotidy. V
Třetí reakce
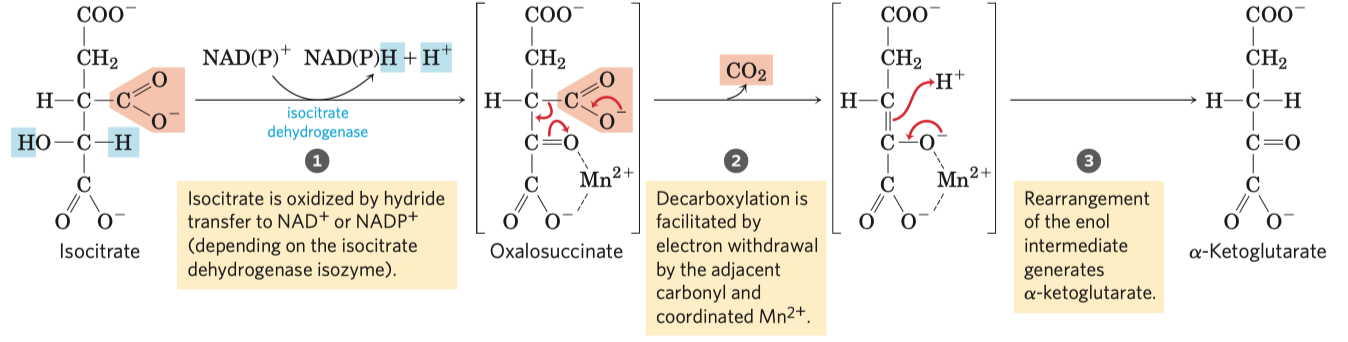
Toto je první dekarboxylační reakce.
Čtvrtá reakce
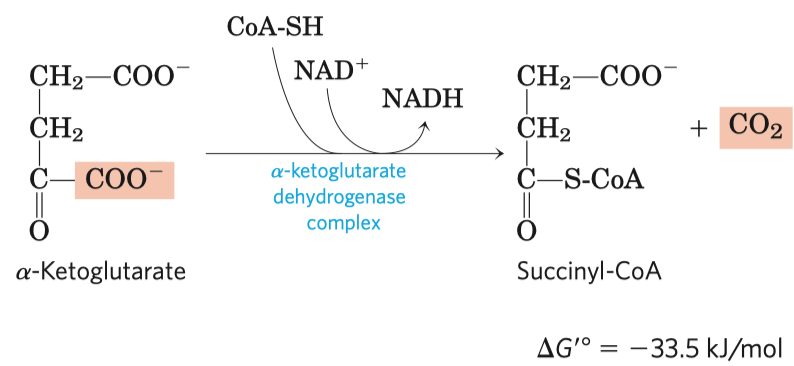
Sukcinyl-CoA je opět makroergní molekula.
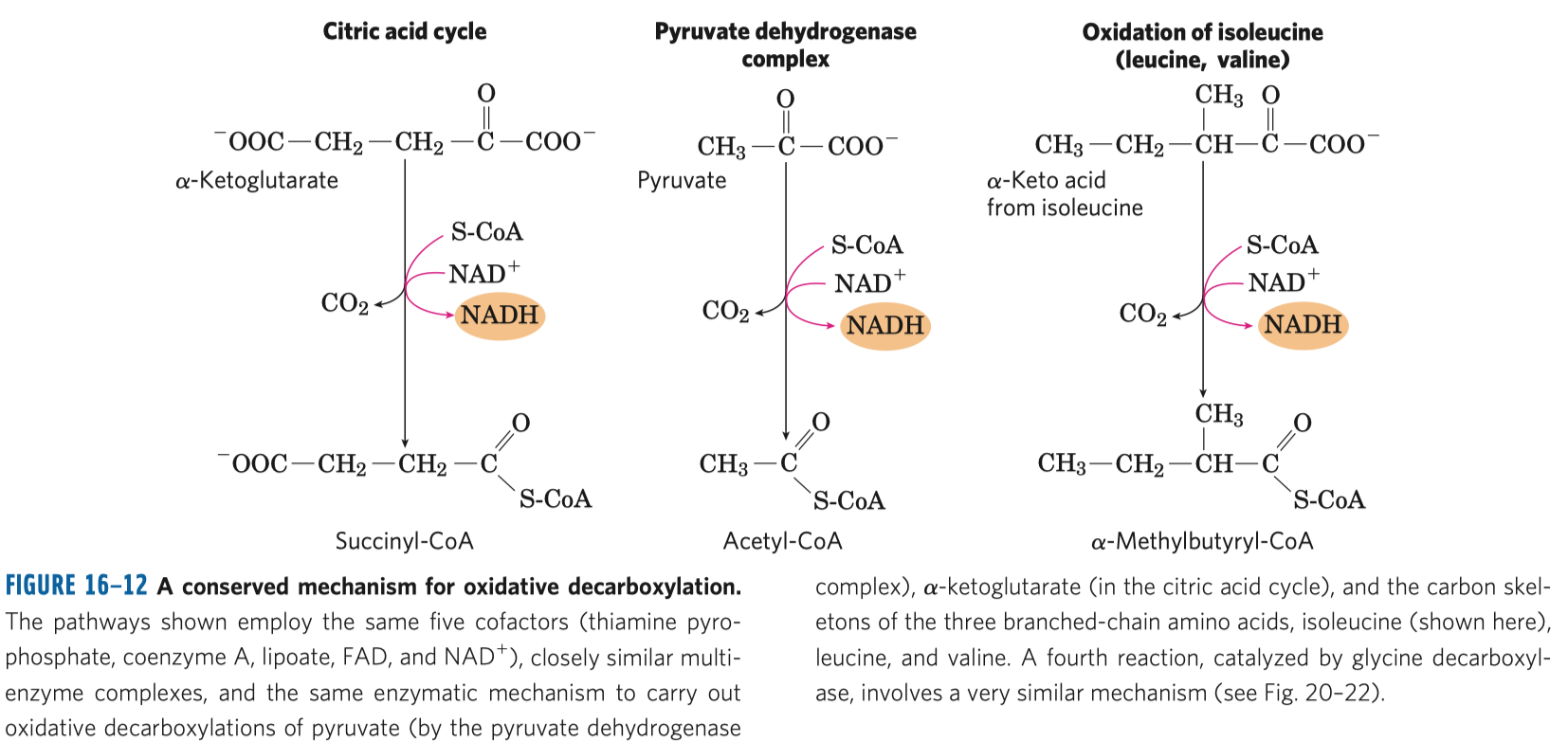
- podobný mechanismus funkce (viz obrázek)
- enzymy E1, E2, E3
- inhibice arsenem
- jen substráty jsou odlišné
Pátá reakce
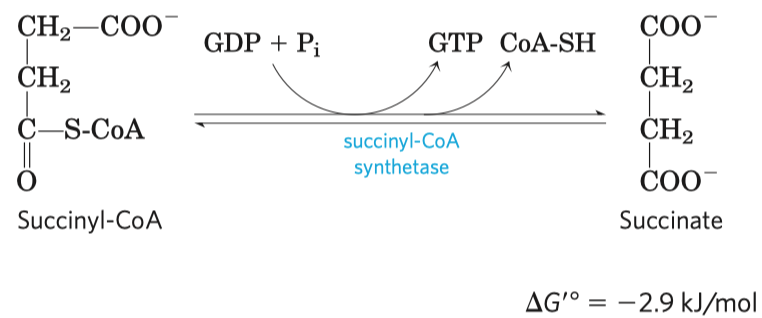
- katalyzováno sukcinyl-CoA syntetáza (jméno má podle reakce opačného směru)
- spíše z historických důvodů, reakce většinou běží směrem sukcináza \(\rightarrow\) sukcinát
- tvoří se kyselina jantarová, neboli sukcinát
- energie vazby s CoA je využita na syntézu makroergní sloučeniny, např. GTP
- vznik sukcinyl-fosfátu
- vznik sukcinátu, přenesení fosfátu na His zbytek v enzymu \(\rightarrow\) vznik makroergní formy enzymu
- fosfát je přenesen na GDP (nebo ADP a podobně), tvoří se GTP (nebo ATP a podobně)
Probíhá tedy tzv. syntéza ATP na substrátové úrovni, která probíhá i v glykolýze. Druhý způsob syntézy ATP je v
Šestá reakce
- enzym sukcinát-dehydrogenáza, koenzym FAD
- FAD funguje zde, v reakci pyruvát \(\rightarrow\) acetyl-CoA a v oxidativní fosforylaci (jako komplex II)
- na rozdíl od ostatních enzymů v KC je vázaný na membránu
- je integrálním membránovým proteinem ve vnitřní
mch membráně \(\implies\) může efektivně předávat elektrony
- je integrálním membránovým proteinem ve vnitřní
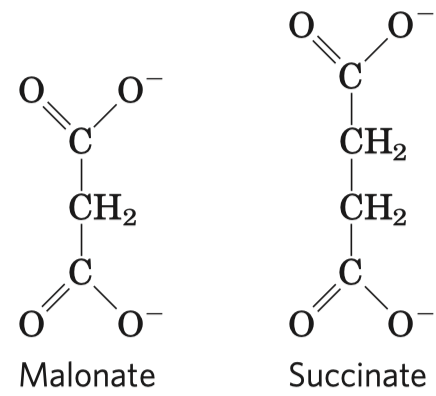
- (doslova) učebnicový příklad enzymu manifestujícího kompetitivní inhibici
- kyselina malonová je stejně jako sukcinát také dikarboxylová a liší se od něj pouze v jedné skupině (viz obrázek)
- řešením je přidat více sukcinátu
- inhibiční vlastnosti malonátu přišly vhod při zkoumání KC
Sedmá reakce
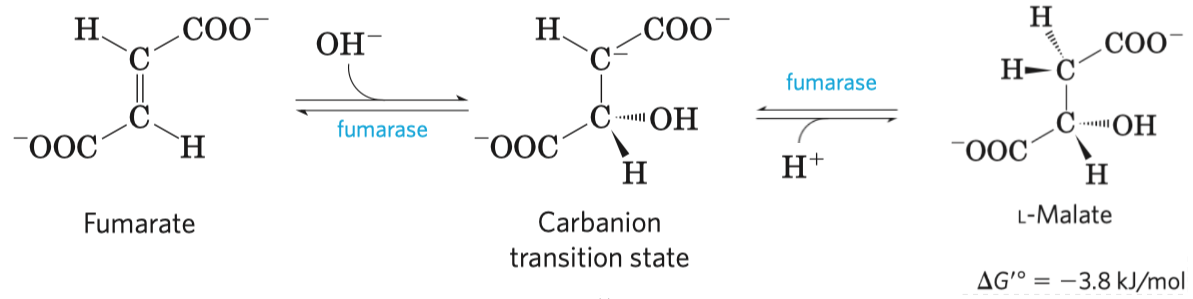
Malát je jiným názvem kyselina jablečná.
Osmá reakce
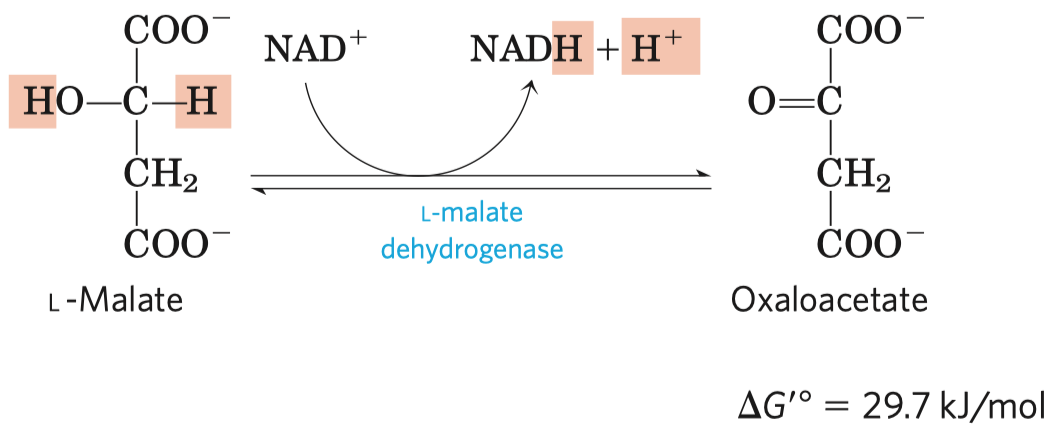
Probíhá regenerace oxalacetátu.
Regulace KC
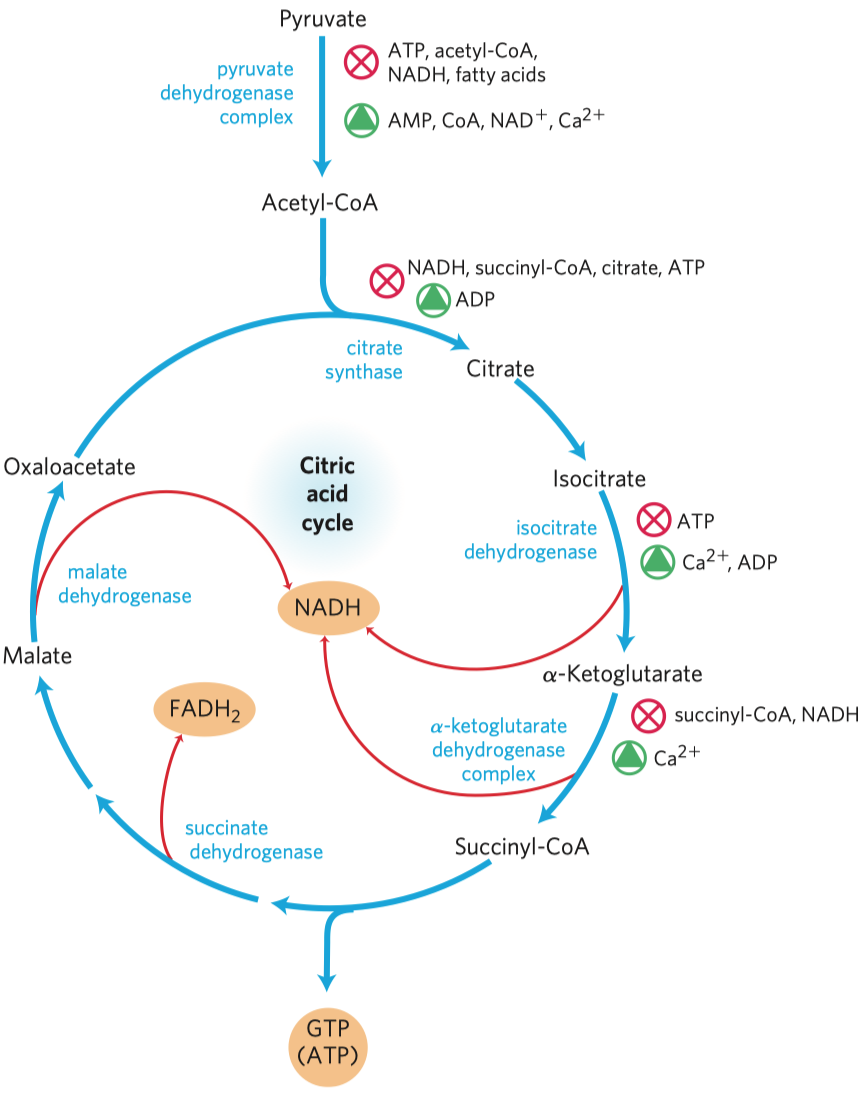
- nejdůležitější jsou následující tři enzymy (jejich inhibice/aktivace)
- citrát-syntázová reakce
- izocitrát-dehydrogenáza
- α-ktetoglutarát-dehydrogenáza
Intermediáty KC
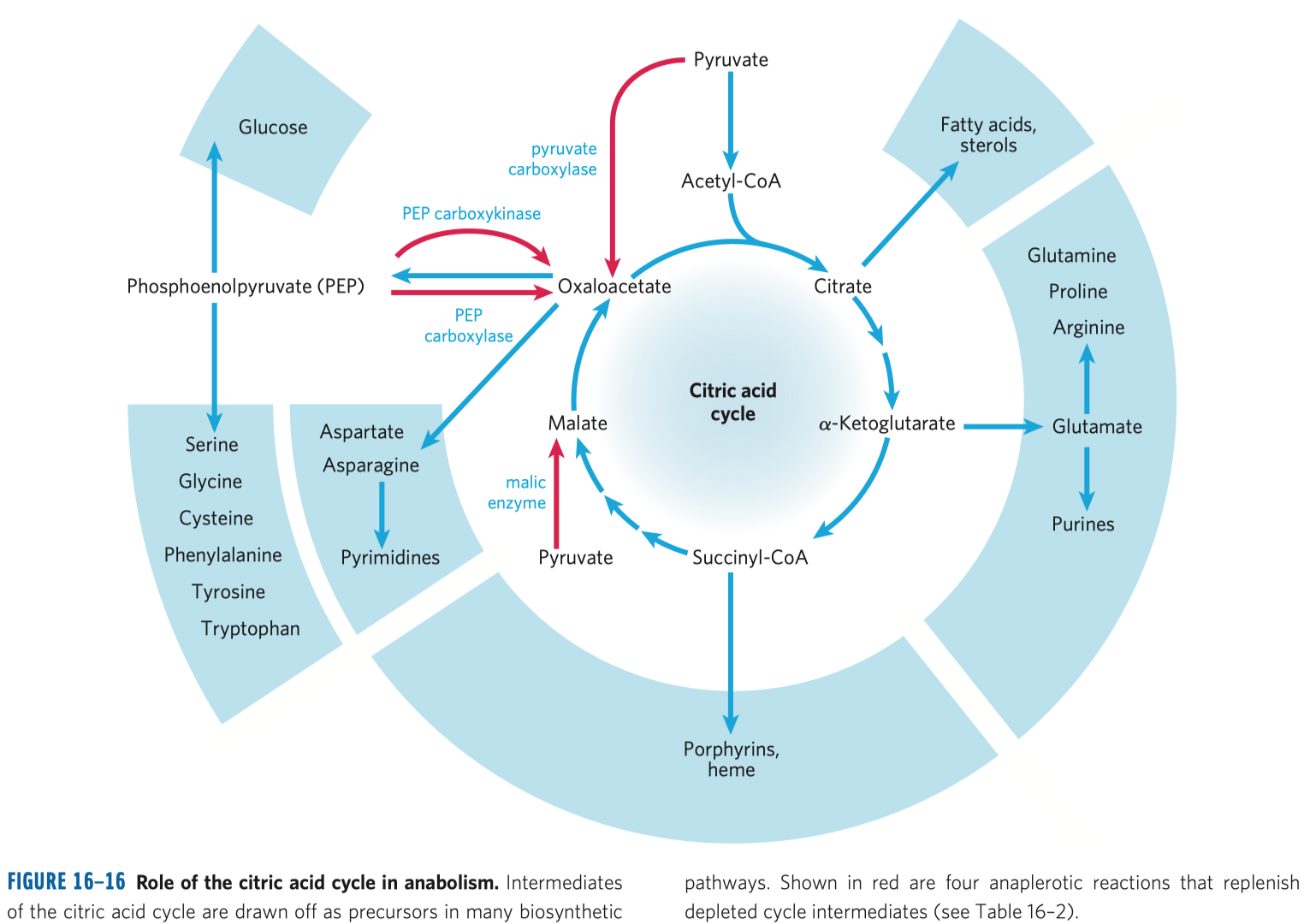
Citrát si může “odskočit” do cytoplasmy, kde probíhá syntéza mastných kyselin; další itermediáty slouží k dalším syntézám. Celý cyklus má tedy katabolický i anabolický charakter.
Anaplerotické reakce
- někdy dojde oxalacetát, protože na různých místech utíkají intermediáty do syntéz
- anaplerotické (= doplňující) reakce oxalacetát doplňují, viz červené šipky na obrázku
- výchozí molekulou jsou intermediáty metabolismu cukrů (pyruváty a fosfoenolpyruváty, poslední dvě molekuly cytoplazmatické glykolýzy)
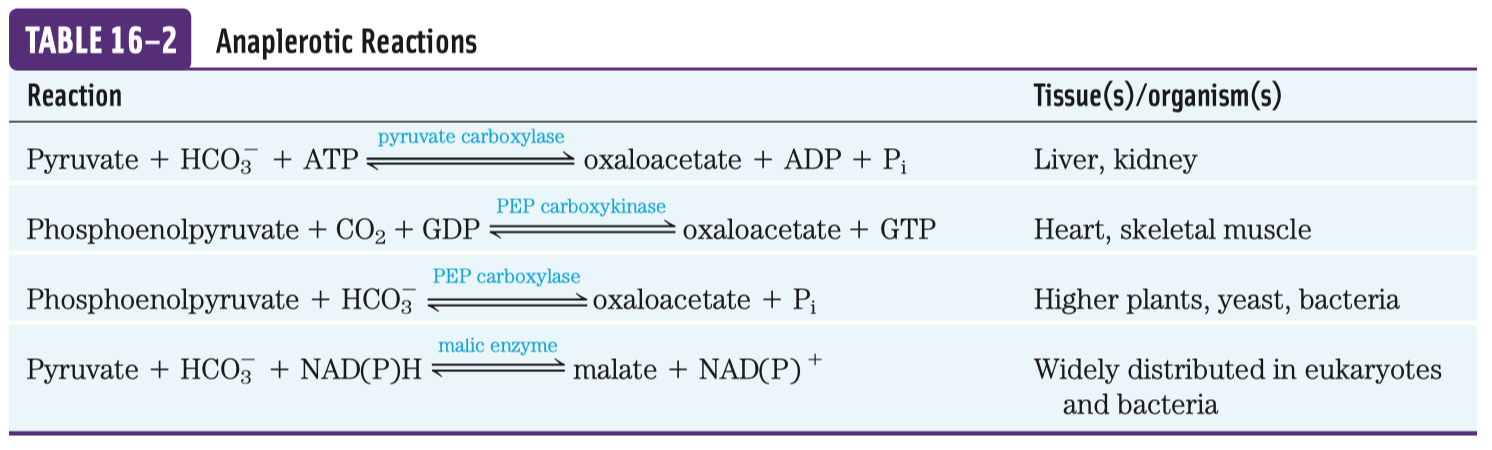
V té poslední (reakce s jablečným enzymem) je zdrojem uhlíku místo
- přes α-ketoglutarát
- přes sukcinyl-CoA
- Asp, Phe, Tyr přes fumarát
Glyoxalátový cyklus
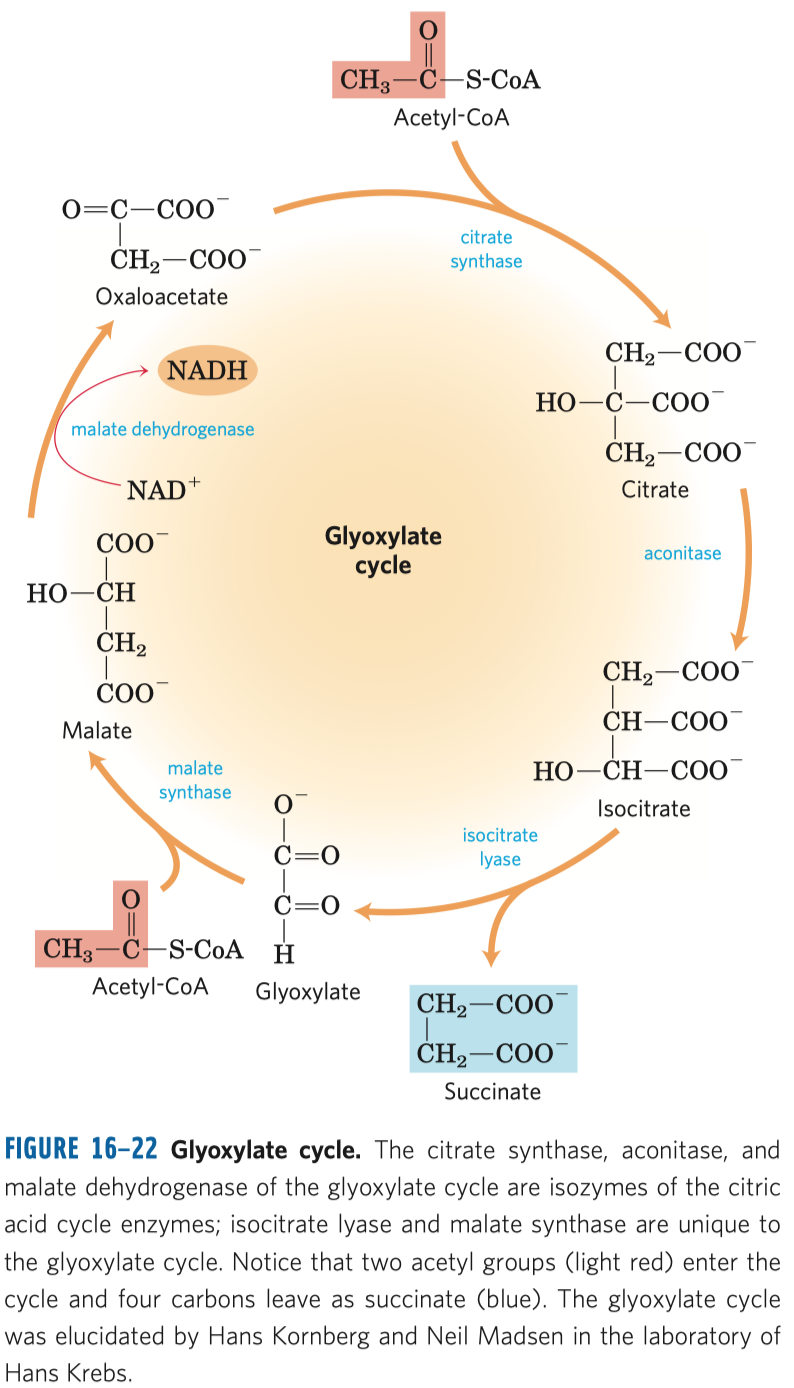
- společné rysy s KC, je to dráha zahrnující některé podobné enzymy, ale je tam o dva enzymy navíc
- probíhá v glyoxysomech v semenech olejnatých rostlin
- glyoxysomy jsou modifikované peroxisomy
- detoxifikační centra
- odbourávají se tam jedy jako ethanol, léky
- látky se oxidují, stávají se rozpustnými a mohou se vylučovat močí
- vzniká zde peroxid vodíku
- citrát syntázová rekce, vznik citrátu
- citrát je následně izomerizován na izocitrát, jako v KC (akonitáza)
- izocitrát lyáza rozštěpí šestiuhlíkatou kyselinu na sukcinát a glyoxalát
- glyoxalát vstupuje do malátsyntázové reakce, jež z něj a z acetyl-CoA udělá malát
- malát už zase vstupuje do klasické reakce KC (malát-dehydrogenáza)
- regeneruje se oxalacetát
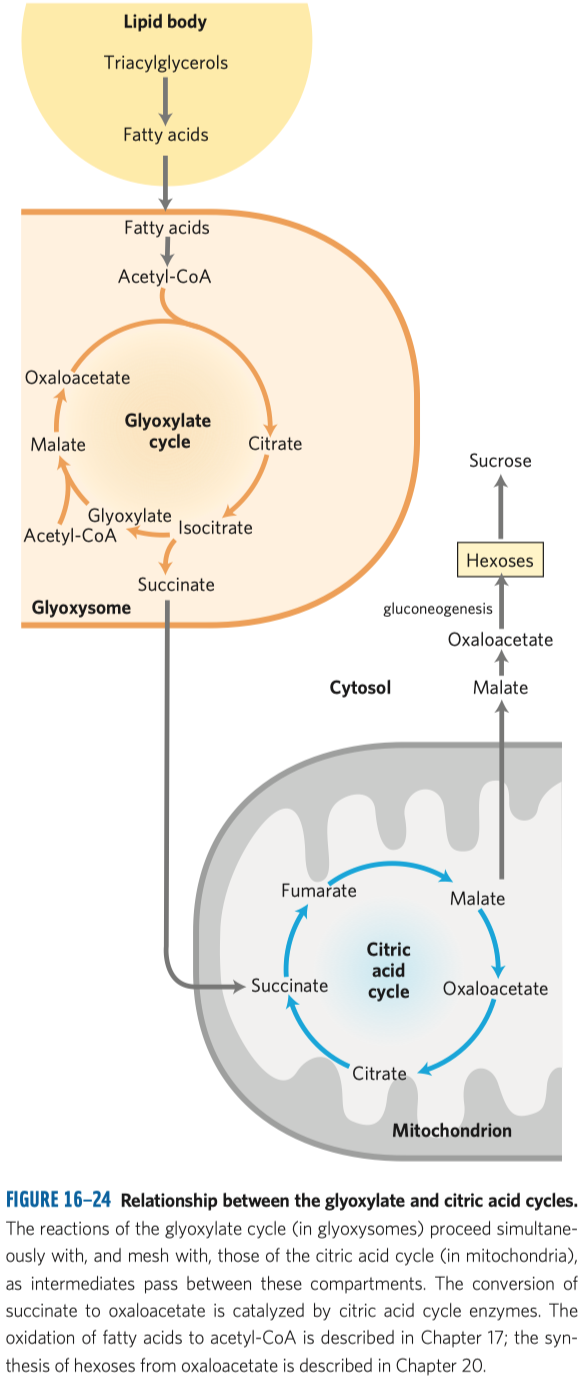
Proč jsou glyoxysomy v semenech?
- semena mají dva typy zásobních substrátů: škrob a tuky
- olejnatá semena u klíčení potřebují cukry, protože samotné tuky nejdou pomocí KC zpracovat \(\rightarrow\) potřebují nasyntetizovat sacharidy z tuků
- v KC nepřebývají žádné uhlíky, které by byly použitelné k syntéze sacharidů
- z glyoxalátového cyklu se uvolní sukcinát, který se může účastnit KC, a později nepřímo poslouží k tvorbě glukózy (viz obrázek)
Oxidativní fosforylace
Dále již jen zkráceně OF.
- dvě reakce: oxidace (transport elektronů z redukovaných koenzymů) a fosforylace
\(\ce{ADP -> ATP}\) - reakce bez sebe nemohou být, jsou spjaty
- probíhá v
mch , kde se (při dostatku kyslíku) vyrábí 96% ATP (zbytek vzniká při glykolýze a jedna molekula v KC) mch mají všechny aerobní organismy (potažmo všechna eukaryota, jen některá je mají pozměněné
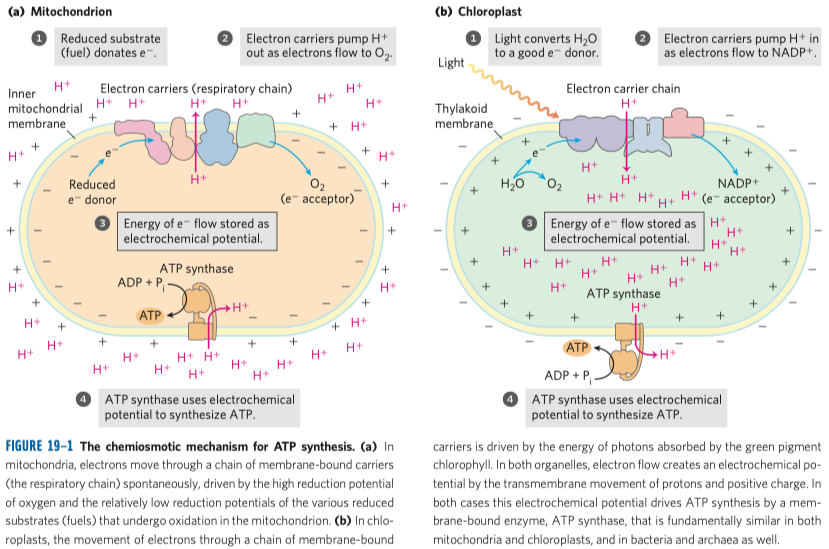
Mitochondrie
- Otto Warburg dostal roku 1931 NC za objevy kolem
mch mch byly popsány na přelomu 19. a 20. století, poměrně brzy byla zjištěna jejich úloha v oxidativním metabolismu- až v 50. letech (George E. Palade) byla na Rockefellerově univerzitě poprvé postavena dobrá centrifuga, která dovedla oddělovat buněčné kompartmenty
- až tehdy se dala studovat čistá
mch frakce - Palade dostal NC v roce 1974 spolu s Christianem de Duve (který objevil peroxisomy) a Albertem Palade
- až tehdy se dala studovat čistá
Struktura mch
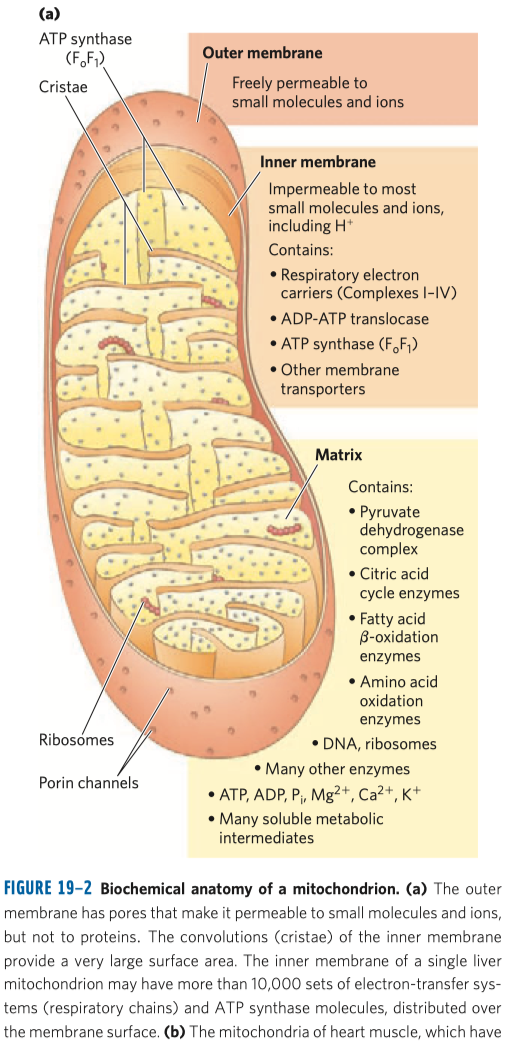
- má póry z porinů, které slouží k transportu proteinů do
mch –tedy je dost propustná
- reakce s metabolismem nukleotidů, např. při udržování úrovně nukleotidů (
\(\ce{ADP <=> ATP}\) ) dovede měnit nukleotidy v sebe sama - jsou tu i důležité signální molekuly ohledně energentického stavu buňky
- nařasená kristami
- původní představa velkých vchlípenin se ale opouští, současný názor je takový, že vchlípeniny jsou spíše tunýlky
- tunýlky teoreticky mohou měnit průměr svého vstupu (přelomu mezi tunýlkem a mezimembránovým prostorem), čímž by se mohl tvořit v mezimembránovém prostoru nějaký gradient
- jsou v ní zanořené komplexy OF
- je vlastně nepropustná, neprojde přes ní nic, pro co tam není transportní systém (kromě krátkých MK a plynů)
\(\ce{CO2}\) vzniká v KC a kyslík je tam potřeba jako finální akceptor elektronů- neprojdou ale třeba protony, to je základ OF
mch jsou semiautonomní, obsahují vlastní DNAmch genů je u člověka 13, všechny kódují nějaký protein patřící do komplexu z OF- postupem času se geny přesouvaly z
mch do jádra - těch 13 proteinů zůstalo, protože jsou natolik hydrofobní, že by nemuseli přečkat cestu přes cytoplasmu
- postupem času se geny přesouvaly z
- komplexy se většinou skládají z
mch i běžných proteinů, které jsou domch transportovány z cytoplasmy- mitopatie = chyby v koordinaci skládání (celkem časté)
- původní představa:
mch mají na délku asi\(\pu{2 \mu m}\) , jsou tedy velikostně podobné bakteriím - současná představa:
mch jsou spíše dynamickým retikulem- existuje dynamická sít
mch , které se neustále slučují, pohybují, mění tvar - nejspíše ve všech buňkách kromě svalových (tam není místo) a spermií (tam jsou
mch kolem bičíku)
- existuje dynamická sít
- v
mch se tvoří kyslíkové radikály \(\implies\) rychle stárnou, jsou rychle odstraňovány (autofagocytózou) a obnovovány - ke změnám ve tvaru a uspořádání
mch může dojít otravou, zablokováním OF, ale tvar mohou měnit i v závislosti na energetickém stavu buňky- potřeba vysoké produkce ATP \(\implies\) zvýšení objemu
- v opačném případě fragmentace a snížení objemu
Oxidace (elektron-transportní řetězec)
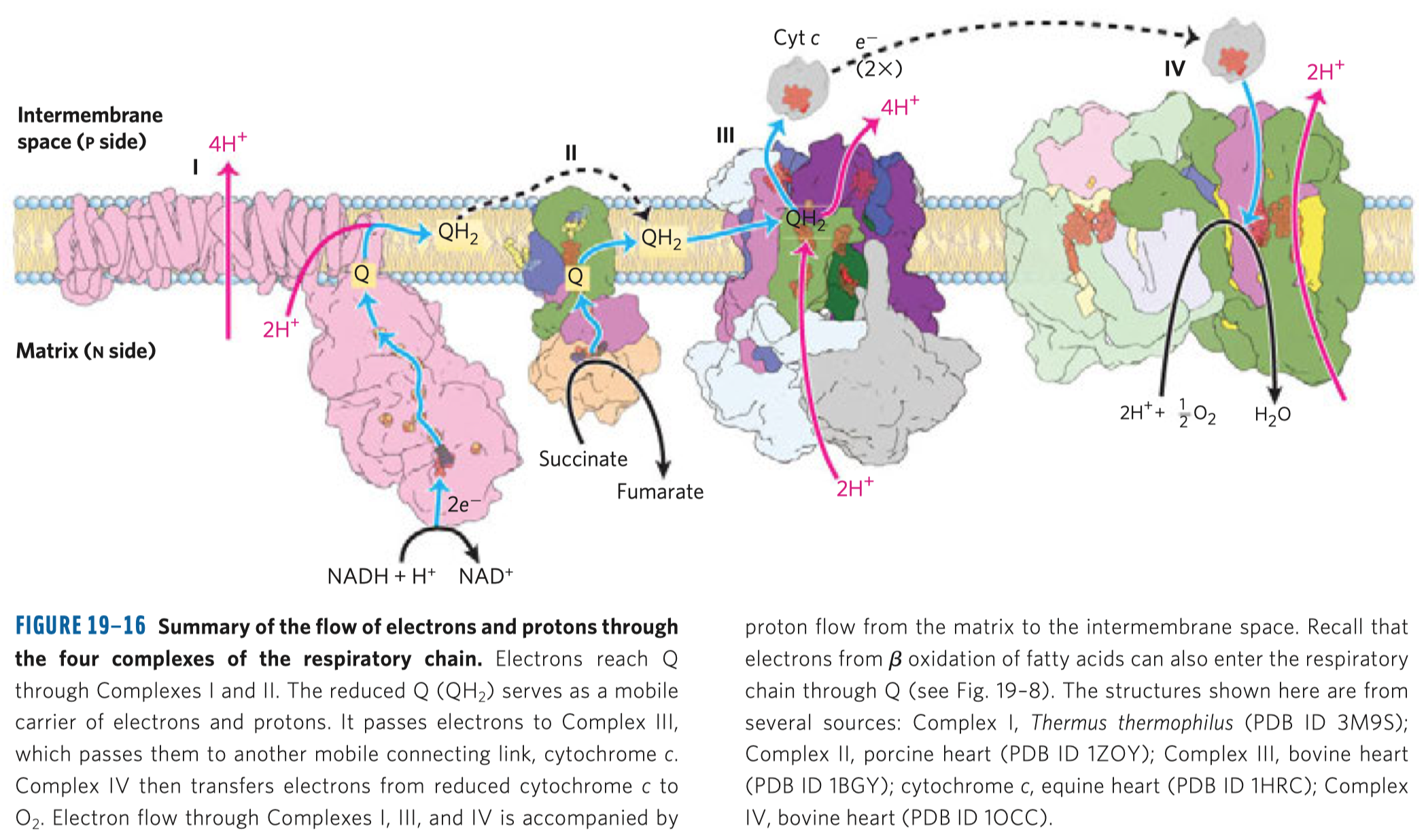
- probíhá při redoxních reakcích (donor se oxiduje, akceptor redukuje)
- v oxidační části je elektronový pár nesen z primárního donoru (redukovaný koenzym
\(\ce{NADH}\) nebo\(\ce{FADH2}\) ) přes přenašeče až na finální akceptor\(\ce{O2}\) - zjednodušený nákres ukazuje, že se řetězec skládá ze čtyř komplexů (I–IV), které jsou všechny ukotveny ve vnitřní
mch membráně- kromě těchto čtyř velikých proteinových komplexů jsou tam ještě dva mobilní přenašeče, kteří se pohybují mezi těmi velkými
- koenzym Q (1 \(\leftrightarrow\) 3, 2 \(\leftrightarrow\) 3)
- cytochrom C (3 \(\leftrightarrow\) 4)
- kromě těchto čtyř velikých proteinových komplexů jsou tam ještě dva mobilní přenašeče, kteří se pohybují mezi těmi velkými
- látky vstupují buď na místě I,
\(\ce{NADH}\) , nebo na II, kde je sukcinát-dehydrogenáza s flavinovým koenzymem\(\ce{FADH2}\)
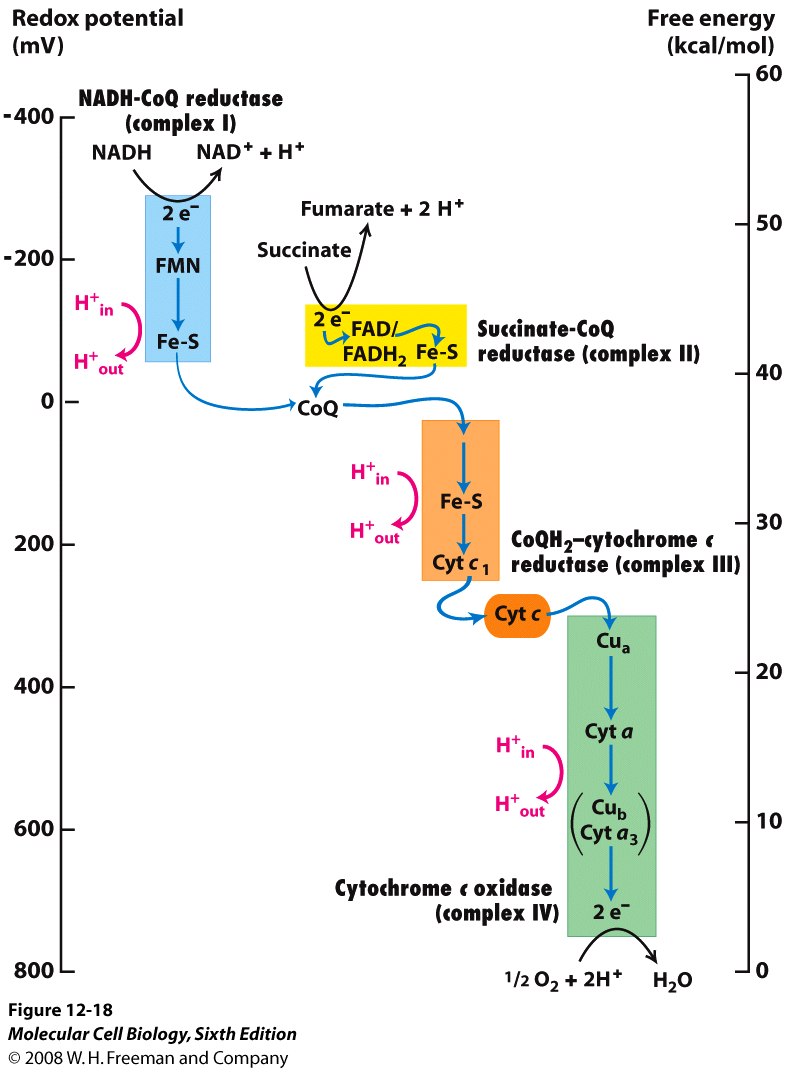
- jedna osa ukazuje redox potenciál v milivoltech, druhá osa ukazuje volnou energii, která se při přenosu uvolní
- nejvýše je soustava NADH-NAD
- obecně platí, že putují elektrony ze soustavy o nízkém redox potenciálu na soustavu s vyšším potenciálem
- zde je rozdíl více než
\(\pu{1 V}\) , a podle Nernstovy rovnice se dá spočítat, jak velká energie se při takovémto přenosu uvolní- více než
\(\pu{200 kJ/mol}\) , tam se vejde cca 7 molekul ATP
- více než
Redoxní centra
- molekuly, které umí měnit svůj oxidační stav
- starají o to, aby byl elektron na jedné straně přijat a na druhé odevzdán
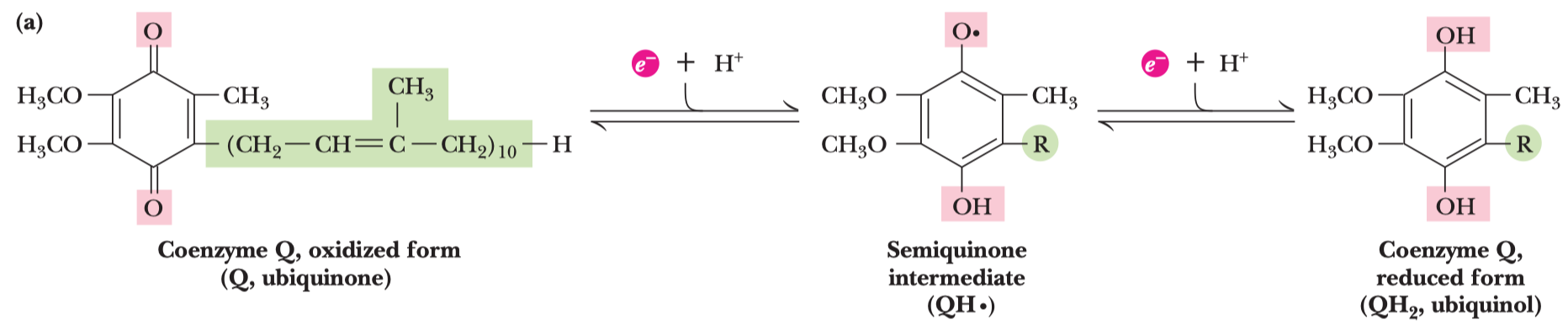
- jiné názvy: ubiquinon, ubichinon (byl nalezen všude možně po buňce, byl tedy ubiquitous), koenzym Q10 (viz níže)
- pohyblivý přenašeč elektronů, běhá ve vnitřní membráně a nosí elektrony mezi komplexy
- má dlouhý hydrofobní ocásek, celý je tedy také hydrofobní
- proto je uvnitř membrány
- v ocásku se desetkrát opakuje jeden motiv \(\rightarrow\) název koenzym Q10
- jsou různé typy koenzymů od Q1 až po Q10
- může být v radikálové formě a vázat jen jeden elektron, nebo může být v plně oxidované a vázat dva
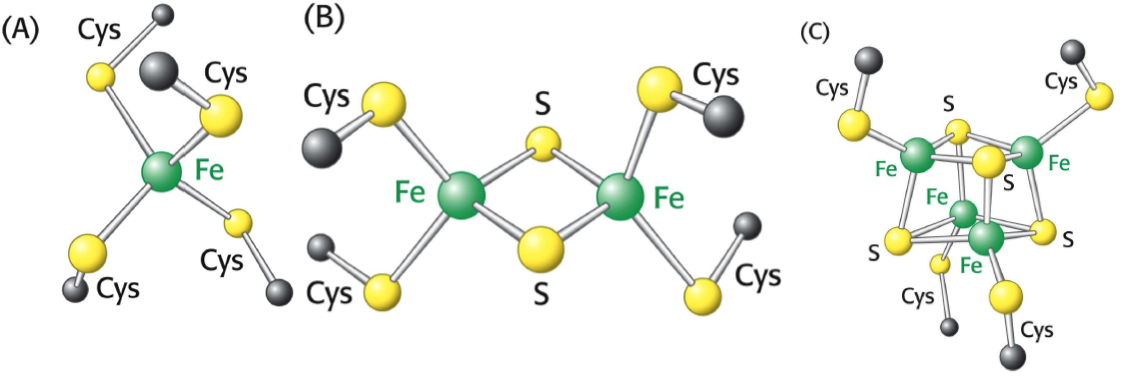
- má v sobě železosirný komplex
- účastní se reakce tak, že uvolní
\(\ce{Fe^2+}\) a spustí Fentonovu reakci
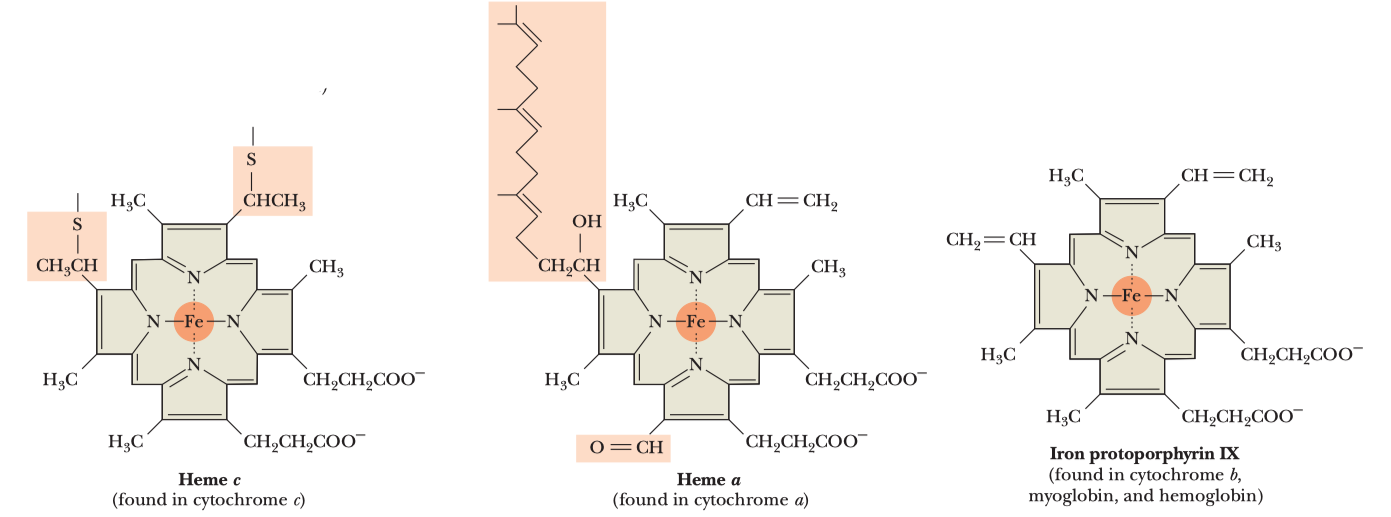
- proteiny s hemovým železem, hemem
- tvoří se porfyrinový kruh přes 4
\(\ce{N}\) je vázáno jedno\(\ce{Fe}\) (může přecházet na\(\ce{Fe^2+}\) a\(\ce{Fe^3+}\) ) - je několik typů cytochromů
- dělí se podle toho, jaké typy hemů jsou v nich vázány—A, B či C
- hemy A, B a C se liší ukotvením v proteinu a postranními řetězci navázanými na porfyrinový kruh
- ještě se tam podílí měď, ale není v žádném komplexu
- cytochromy jsou důležité pro experimenty, různě absorbují světlo
- CytC při třech vlnových délkách absorbuje silně
- navíc absorbuje různě v oxidovaném a redukovaném stavu \(\rightarrow\) dobrý způsob jak měřit průběh metabolismu v organismu je sledování změny absorbance
Komplex I
Jinými názvy též NADH dehydrogenáza, NADH:koenzym Q oxidoreduktáza.
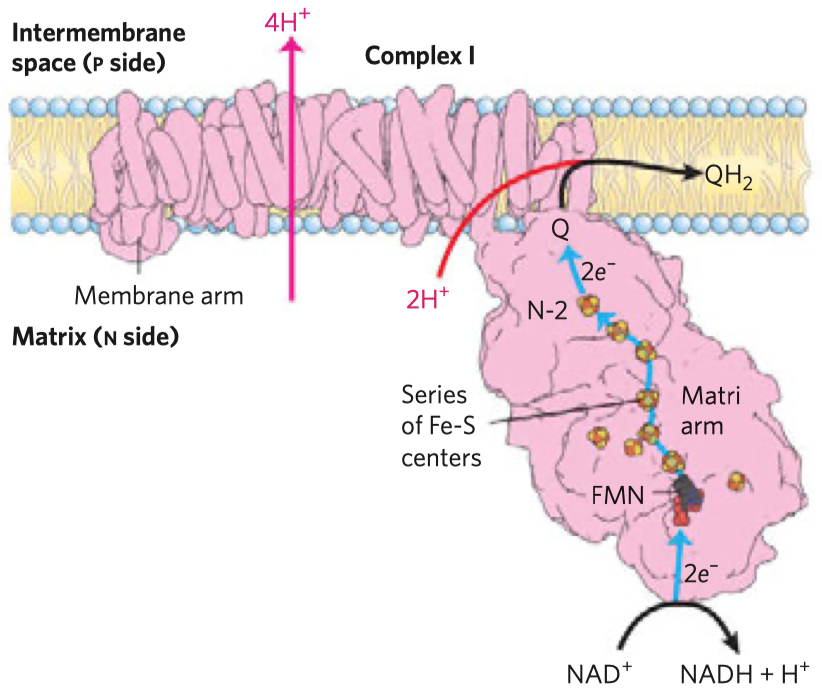
- má tvar L, jsou rozlišitelné dvě domény
- transmembránový Lys, hlavička je zanořená do lumen
- jsou na něm redoxní centra
- na špičce je místo pro redukovaný koenzym
- je to jedno z největších takových center, má až 45 podjednotek
- bakteriální mají kolem 15 podjednotek, v průběhu evoluce se postupně přidávaly další a další
- 7/45 podjednotek se kóduje v
mch DNA, zbytek v jádrovém DNA
- na špičku se napojí redukovaný koenzym
- předá dva elektrony prvnímu redoxnímu centru, tím se oxiduje
- elektrony putují po dalších centrech
- těchto center je v komplexu 7–10
- flavin-mononukleotid (FMN) \(\rightarrow\) série železo-sirných center s různým proteinovým prostředím
- redoxní potenciál se postupně zvyšuje -v průběhu se z matrix vypumpují čtyři protony
- těchto center je v komplexu 7–10
Komplex II
Jinými názvy též sukcinát-dehydrogenáza, sukcinát:koenzym Q oxidoreduktáza.
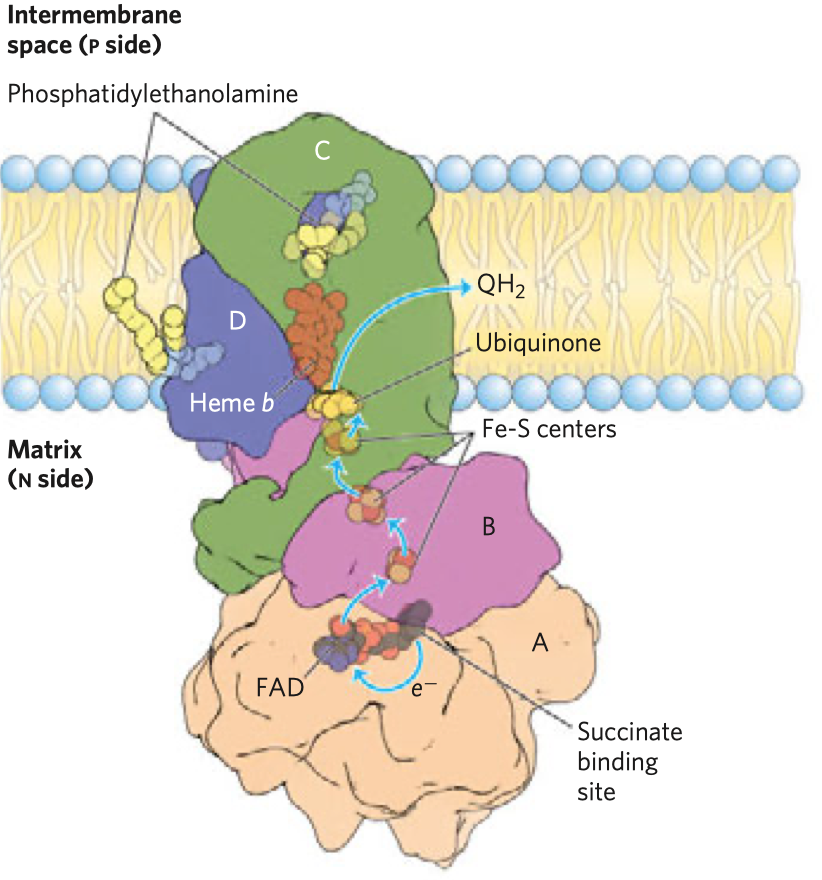
- komplex ze 4 podjednotek
- žádná není kódována v
mch
- žádná není kódována v
- několik redoxních center
- tři železo-sirná centra
- jeden FAD
Koenzym Q se však redukuje i jinými způsoby než přes komplexy I a II, viz obrázek níže. Jde zároveň vidět, že FAD figuruje i na jiných místech, např. v oxidaci mastných kyselin.
Komplex III
Neboli cytochrom B-C1.
- obsahuje cytochromy B a C1 (\(\rightarrow\) jméno) a kromě nich ještě obsahuje jeden Fe-S komplex, který se nazývá Rieskeho protein
- funguje jako dimer (na obrázku světlejší a tmavší odstíny barev) a každý z monomerů je asi z 10 podjednotek (dodnes to není jisté a různé organismy to mají různě)
- pouze 1/10 je kódován v
mch
- pouze 1/10 je kódován v
- dochází k rozdělení dvouelektronového přenosu na jednoelektronový—dvoufázový Q cyklus, viz obrázek
- během Q cyklu se přepumpují 4 protony (dvě fáze, ve kterých se obě H z
\(\ce{QH2}\) vypumpuje mimo matrix) - pro funkci je důležité, že jsou všechna vazebná místa lokalizována na různých místech komplexu
- pro pumpování je důležité, že je vazebné místo pro Q blízko transmembránové části (protony pak jednodušeji odletí)
Komplex IV
Jiným názvy též cytochromoxidáza, cytochrom C:kyslík oxido-reduktáza, cytochrom A-A3, nebo COX.
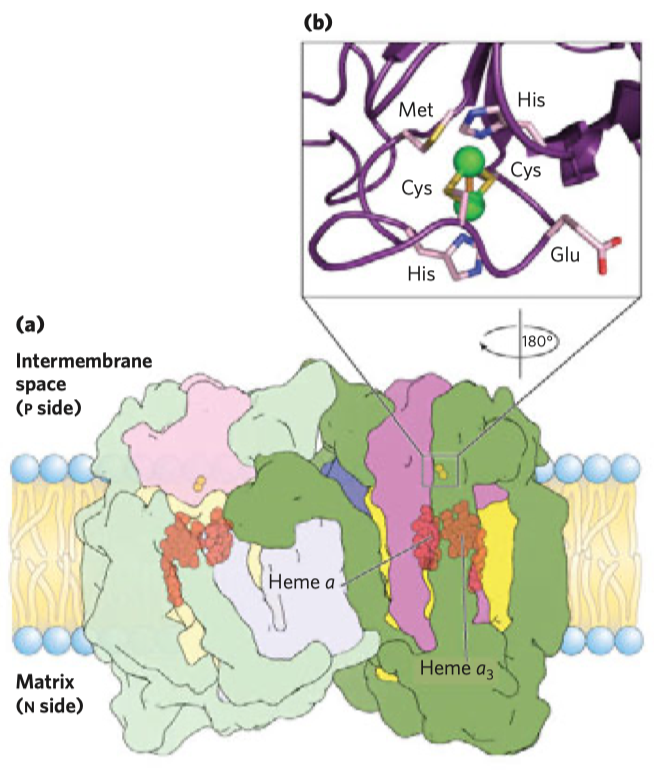
- obsahuje asi 12 podjednotek, z toho 3 jsou kódovány v
mch - funguje jako dimer, důležité komponenty jsou čtyři redoxní centra
- všechna redox centra jsou kódována v
mch
- všechna redox centra jsou kódována v
- dva cytochromy, A a A3
- obsahuje atomy mědi, které jsou koordinovány přes Cys a His
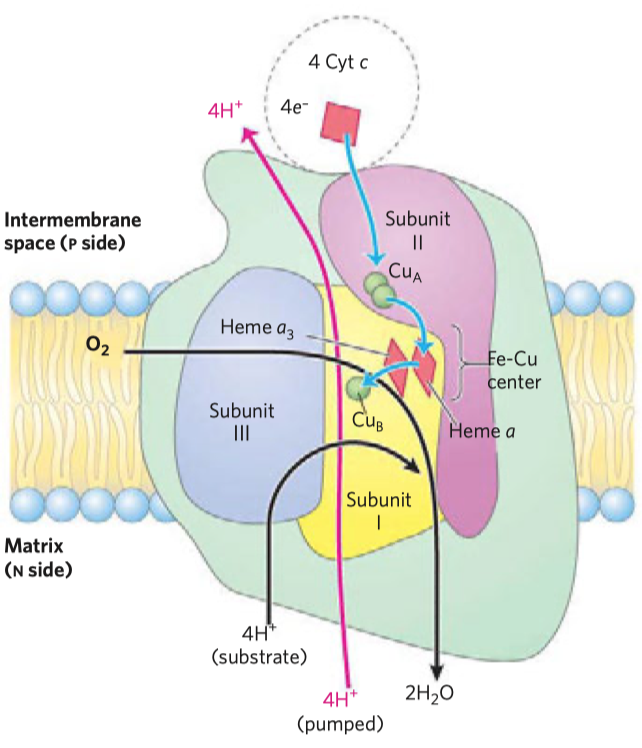
- dovede elektrony a protony předávat na kyslík tak, že vznikne molekula vody
- primitivnější to nedokáží a dělají místo toho peroxid vodíku—ten je však také radikálový a nebezpečný, katalázový systém ho musí pak tedy rozložit na vodu a kyslík, aby nedělal paseku
- průběh
- čtyři redukované
\(\ce{H}\) jsou neseny přes podjednotku 2 na binukleární komplex s atomy mědi - poté jsou přes hemy neseny na druhou měď
- zároveň jsou na kyslík předávány 4 elektrony a do jeho blízkosti i 4 protony
- nakonec vzniknou dvě molekuly vody
- čtyři redukované
- při tom všem jsou přepumpovány 4 protony (dva páry)
- superkomplexy oxidační fosforylace (komplexy I–V)
- metabolické celky \(\rightarrow\) ulehčení pohybu Q a cytochromu C, transport mezi komplexy je rychlý
- kontroverzní, neví se, zda existují
Co se ovšem ví, je fakt, že ATP syntázy se do větších celků shlukují. Jak se zdá, jsou tyto superkomplexy zčásti zodpovědné za morfologii vnitřní membrány v
- za dvě “kola”: 8 (I) + 0 (II) + 8 (III) + 4 (IV) = 20, průměrně za jedno kolo tedy 10
- to platí pouze pokud reoxidujeme
\(\ce{NADH}\)
- to platí pouze pokud reoxidujeme
- pokud reoxidujeme
\(\ce{FAD}\) , přeskakujeme první komplex a přepumpujeme tedy jen 6 protonů
- některé rostliny umí protonový gradient využívat na teplo
- obsahují alternativní oxidázy redukovaných koenzymů, které díky přenosu redukčních ekvivalentů tvoří teplo
- rostou díky tomu ve sněhu
- jiné rostliny gradient využívají k rychlejšímu emitování pachových molekul
U lidí se energie oxidace také využívá, k netřesové termogenezi.
Kyslíkové radikály
- byly objeveny relativně nedávno a zpočátku se jim přisuzovala jen negativní úloha
- mohou však sloužit i jako signální molekuly –informují o hladině kyslíku,
- na jejich existenci a produkci je založena teorie stárnutí
- jejich produkce postupně ničí
mch a snižuje výkonnost buněk a produkci energie \(\rightarrow\) organismus stárne a zahyne
- jejich produkce postupně ničí
- jako hlavní místo produkce kyslíkových radikálů (reactive oxygen species, ROS) se uvádí koenzym Q, ale není to přesné, hlavním místem je komplex BC1, kde dochází k rozdělení přenosu elektronů
- superoxid-dismutáza:
\(\ce{O^. -> H2O2}\) - glutathion-peroxidáza:
\(\ce{H2O2 -> H2O + O2}\) - nejdůležitější
- aktivní látka glutathiol
- tripeptid, je tam důležitá molekula Cys
- síra může být redukována i oxidována, umí dělat disulfidický můstek
- jako dimer může být spojen disulfidickým můstkem a jako jedna molekula může tuto peroxidázu pufrovat
Fosforylace
- už je potvrzena
- Peter D. Mitchell
- tvrzení, že ATP se tvoří v
mch na základě protonového gradientu- po vytvoření gradientu během první fáze OF se poté v komplexu V, častěji nazývanému
mch ATP syntáza, tvoří ATP
- po vytvoření gradientu během první fáze OF se poté v komplexu V, častěji nazývanému
- někdy též proton-motivní síla
- chemická (koncentrační šložka) + elektrická složka
- hodnota potenciálu je asi
\(\pu{15 mV}\) - rozdíl napětí na membráně a rozdíl koncentrace \(\implies\) je tam rozdílné pH
- hodnota potenciálu je asi
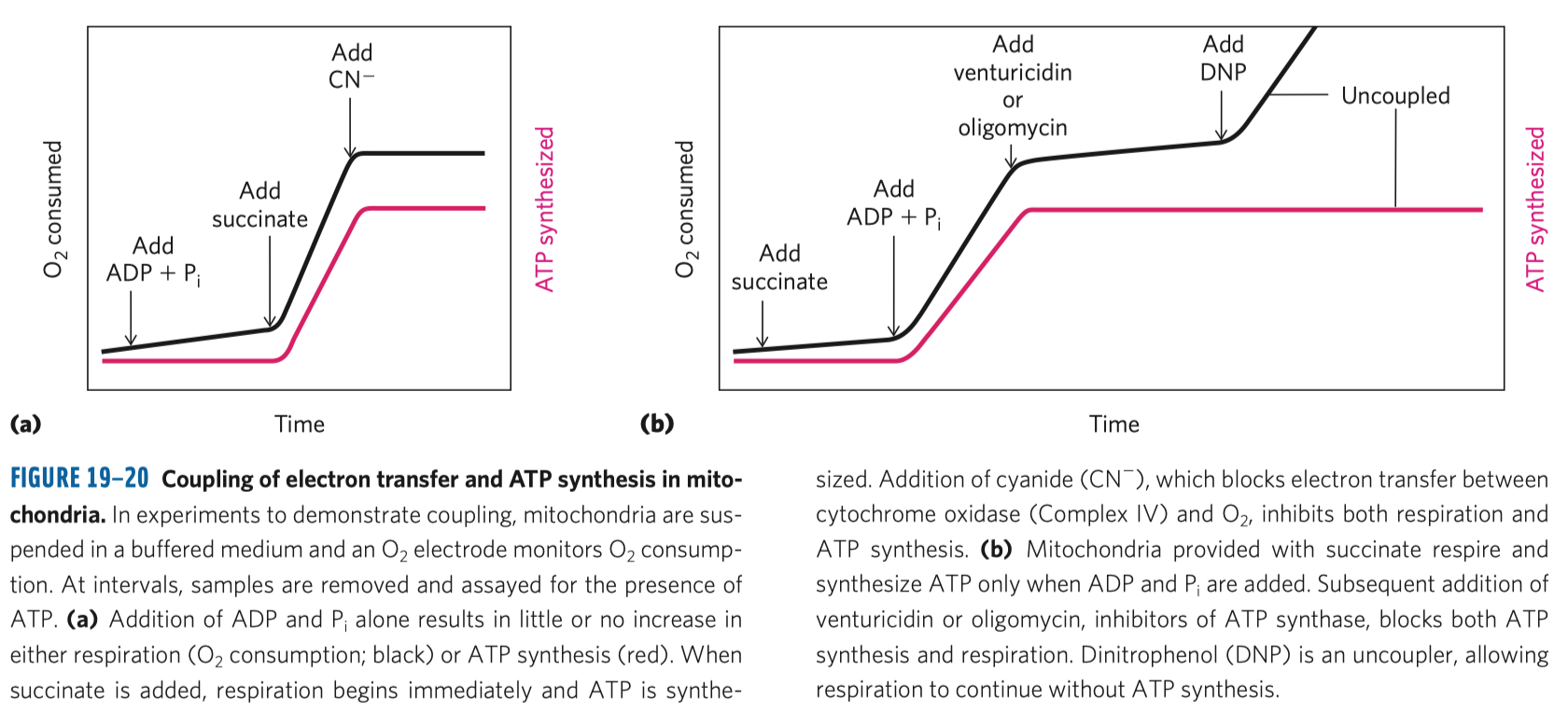
Reakce jsou běžně spřažené, pouze když přidáme látku, která udělá díry v membráně a zruší tím protonový gradient, preparát začne spotřebovávat kyslík, ale už nedělá ATP.
-dotaz na solný můstek: skutečně solný můstkem se rozumí zařízení, kterým se vyrovnává náboj při měření redox potenciálu: máme dvě soustavy ve dvou nádobkách a měříme napětí mezi nimi–tendenci přecházet z jedné na druhou a protože se přenáší i náboj, potřebuje se solný můstek, např. KCl nebo NaCl a ty náboj vyrovnávají.
-sold-bridge-bold také existuje a je to slabá interakce zahrnující vodíkové můstky a elektrostatické interakce uplatňuje se to při skládání proteinu (aspartát, glutamát mohou reagovat a aminoskupinami např. lysinu vod. můstky a elektrostatickými silami)–takže se to může najít i v tomhle významu
- přidáme na membránu bakteriorodopsin
- bakteriorodopsin pumpuje protony poté, co je stimulován světlem
- přidáme na membránu
mch ATP syntázu - posvítíme na membránu \(\rightarrow\) začne se generovat ATP
Struktura ATP syntázy
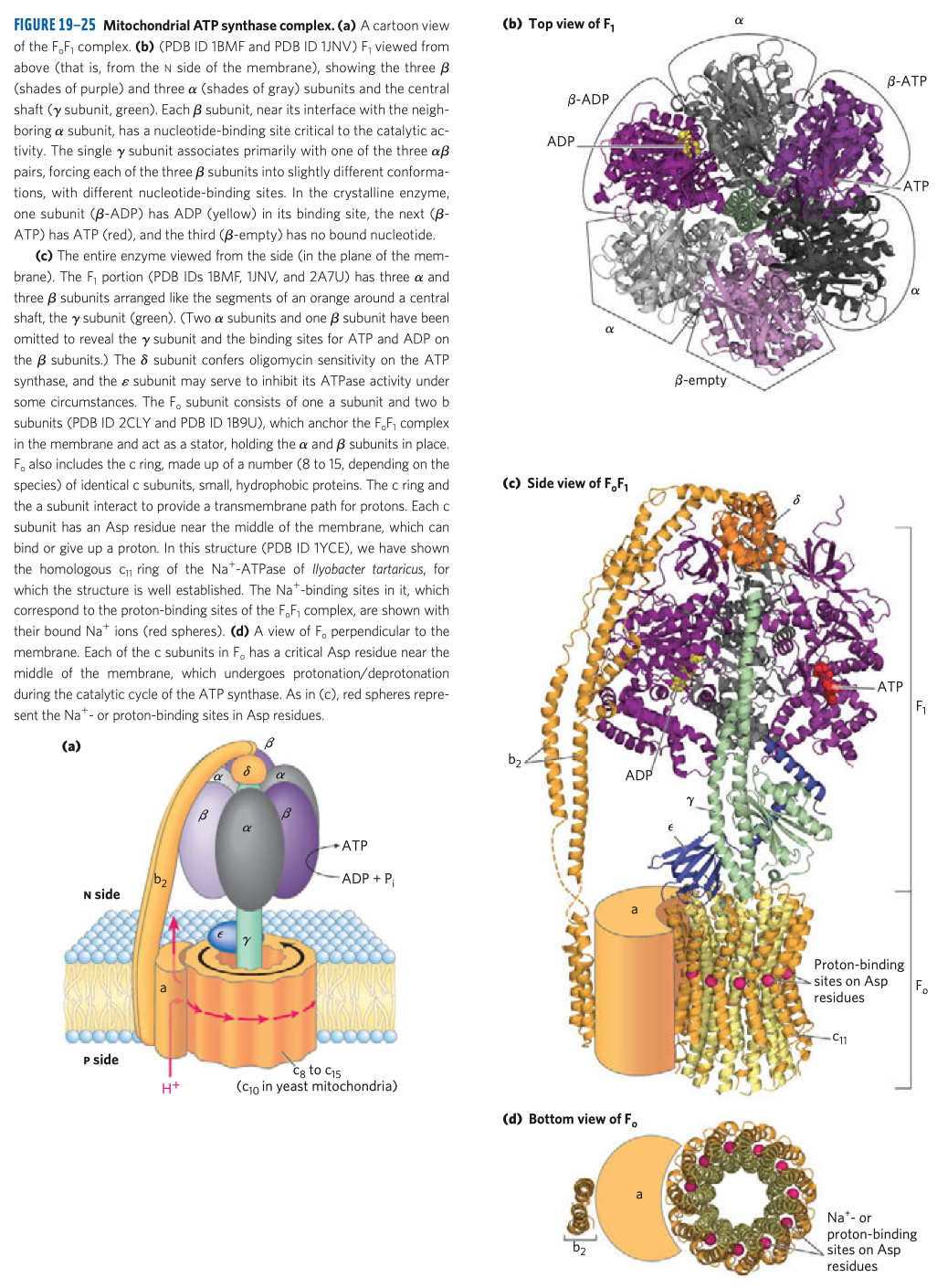
Skládá se ze dvou podjednotek, F1 a FO.
- název se odvíjí z historie
- při působení ureázou se F1 oddělil v jednom celku, kterému se říkalo faktor 1
- je z pěti podjednotek, jsou označeny řecky α–ε, jsou zde v poměru 3:3:1:1:1
- tato stechiometrie (poměr) je zachována v celém spektru sledovaných organismů, přestože samotné proteiny se liší
- očividně stechiometrie a struktura vyplývají z mechanismu
- tato stechiometrie (poměr) je zachována v celém spektru sledovaných organismů, přestože samotné proteiny se liší
- α a β jsou v kruhu, střídají se (seskupení podobné pomeranči)
- tam, kde se stýkají, je vazebné místo pro nukleotidy/ATP
- dovnitř je zasunutá γ podjednotka
- je to taková asymetrická smyčka (na obrázku (c) světle zelená)
- protože je asymetrická, ovlivňuje konformaci α a β podjednotek (viz níže)
- γ se v průběhu syntázy otáčí a periodicky mění konformace jednotlivých α a β podjednotek
- podjednotky δ a ε zproztředkovávají kontakt γ s ostatními transmembránovými podjednotkami
- těsná (T) (na obrázku oblouk), je zde navázáno ATP
- otevřená (O) nebo též empty (na obrázku hranaté), není zde vázáno nic
- volná (L) (na obrázku oblé rohy), je zde navázáno ADP
Průběh změn konformace je T \(\rightarrow\) O \(\rightarrow\) L \(\rightarrow\) T \(\rightarrow\) ...
- FO proto, že je inhibována oligomycinem
- v tom nejjednodušším případě je ze tří podjednotek
- A, protonový kanál
- B, venkovní stonek
- C multimerní prstenec, jenž je uložen ve vnitřní
mch membráně- tužkový model C podjednotky: je to prstenec tvořený různým počtem podjednotek (u bakterií 12, u člověka 8) a je velice důležitý pro výkonnost celého enzymu
- u savců je v ní ještě více podjednotek, které se podílí především na stavbě vnějšího stonku (D, F6, atd.) a na stavbě kanálu
- mají hlavně regulační funkci
Princip funkce
- pracuje jako molekulární motor
- skládá se ze statoru a rotoru, otáčení rotoru způsobuje syntézu ATP
- když protékají protony přes kanál tvořený A, roztáčí prstenec C (viz níže)
- na C je přes δ a ε připojená podjednotka γ, která se tedy otáčí s C
- celý rotor je tedy C + γ + δ + ε
- samotná δ se ale neotáčí, je pevně uchycena k B
- otáčení γ způsobuje syntézu ATP
- A podjednotka má dva hydrofilní půlkanály, jeden vedoucí z P strany a druhý vedoucí na N stranu membrány
- každá C podjednotka (např. v kvasinkách jich je 10) má přibližně v polovině Asp zbytek, který může přijmout/odštěpit proton
- A podjednotka má Arg, který na počátku reaguje s Asp přilehlé C podjednotky
- průběh
- kanálem z P strany přijde proton
- proton se naváže na Asp, což oslabí jeho vazbu s Arg v A podjednotce
- Arg se otočí směrem k protonovanému Asp vedlejší C podjednotky a naváže se na něj
- uvolněný proton odejde kanálem na N stranu
- C prstenec se otočí tak, aby nový Arg-Asp pár byl natočený ke kanálu vedoucímu z P strany
- nový cyklus může započít
- počet protonů, které musí komplexem projít, aby se dokončila jedna otáčka, je tím pádem roven počtu podjednotek v C prstenci
Dle měření se zdá že proběhne přibližně 100 otáček za sekundu.
- viz obrázek níže
- šipka označuje orientaci γ
- když protečou tři protony, dojde k pootočení gamy o 120°
- tím se změní konformace všech tří dvojic (T \(\rightarrow\) O \(\rightarrow\) L \(\rightarrow\) T \(\rightarrow\) ...)
- v kroce [L \(\rightarrow\) T] probíhá kinetická katalýza
- mezi α a β jsou navázané ADP a P
- otočením se změní pozice substrátů tak, že se mezi nimi vytvoří makroergní vazba \(\implies\) sloučí se do ATP
- na jeden cyklus (tři otočení), při kterém vzniknou tři molekuly ATP, je potřeba 9 protonů
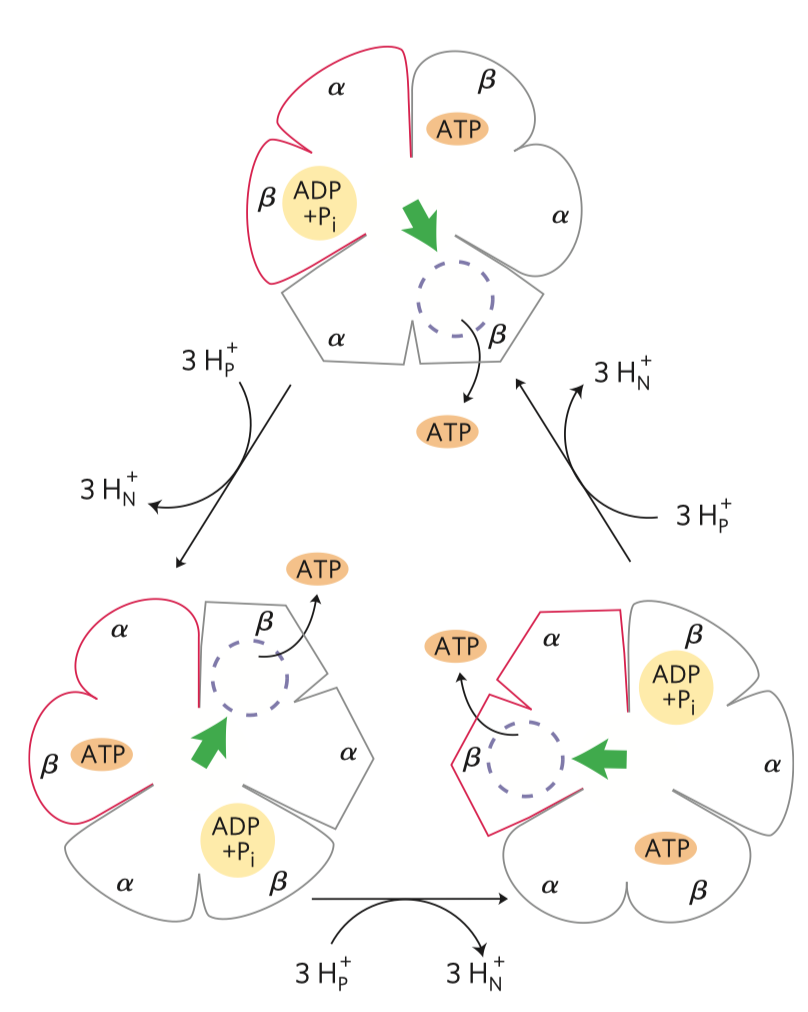
- teoretický zisk: něco málo přes 3 ATP na jeden reoxidovaný NADH
- 10 protonů za jeden NADH, na jedno ATP potřebujeme 3 protony
- reálný zisk je kolem 2,5 ATP
- k výrobě ATP potřebujeme kromě protonů i ADP a fosfát
- k přenosu ADP do
mch se používá adenindinukleotidový translokátor (prohodí ATP a ADP) - anorganický substrát je transportován symportem s protony, tedy na jedno ATP reálně potřebujeme 3 + 1 protonů \(\rightarrow\) za 10 protonů získáme jen 2,5 ATP
- k přenosu ADP do
- k výrobě ATP potřebujeme kromě protonů i ADP a fosfát
- za FADH je to ještě méně, jen 1.5
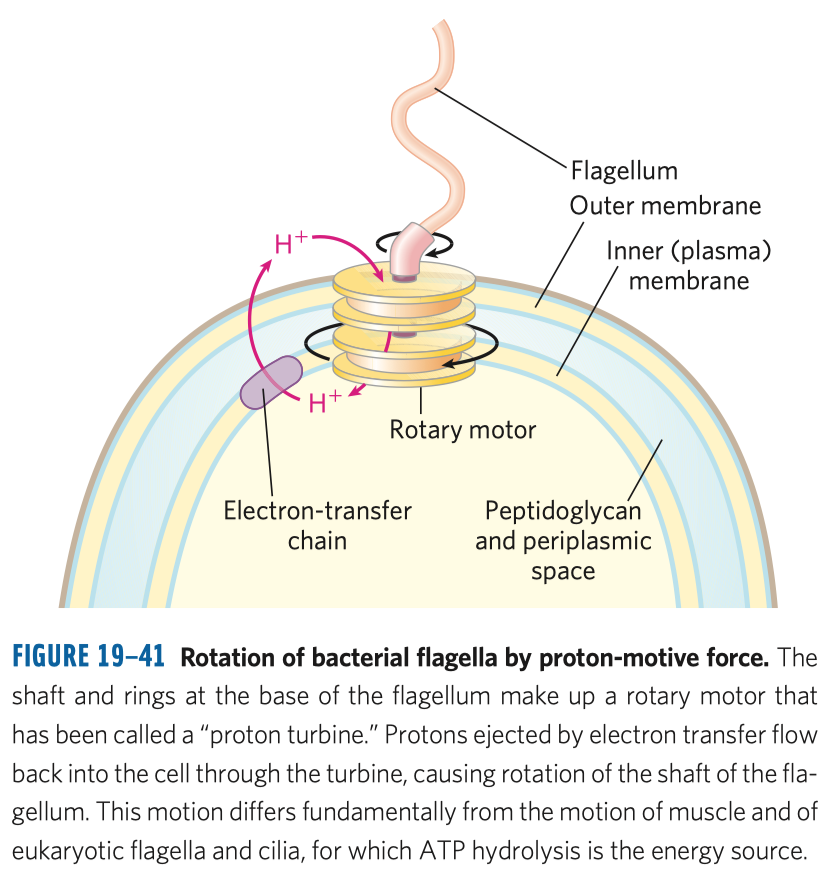
Některé bakterie využívají mechanismus ATP syntázy k pohybu (v opačném směru, tedy ATP \(\rightarrow\) rotace).
Inhibitory
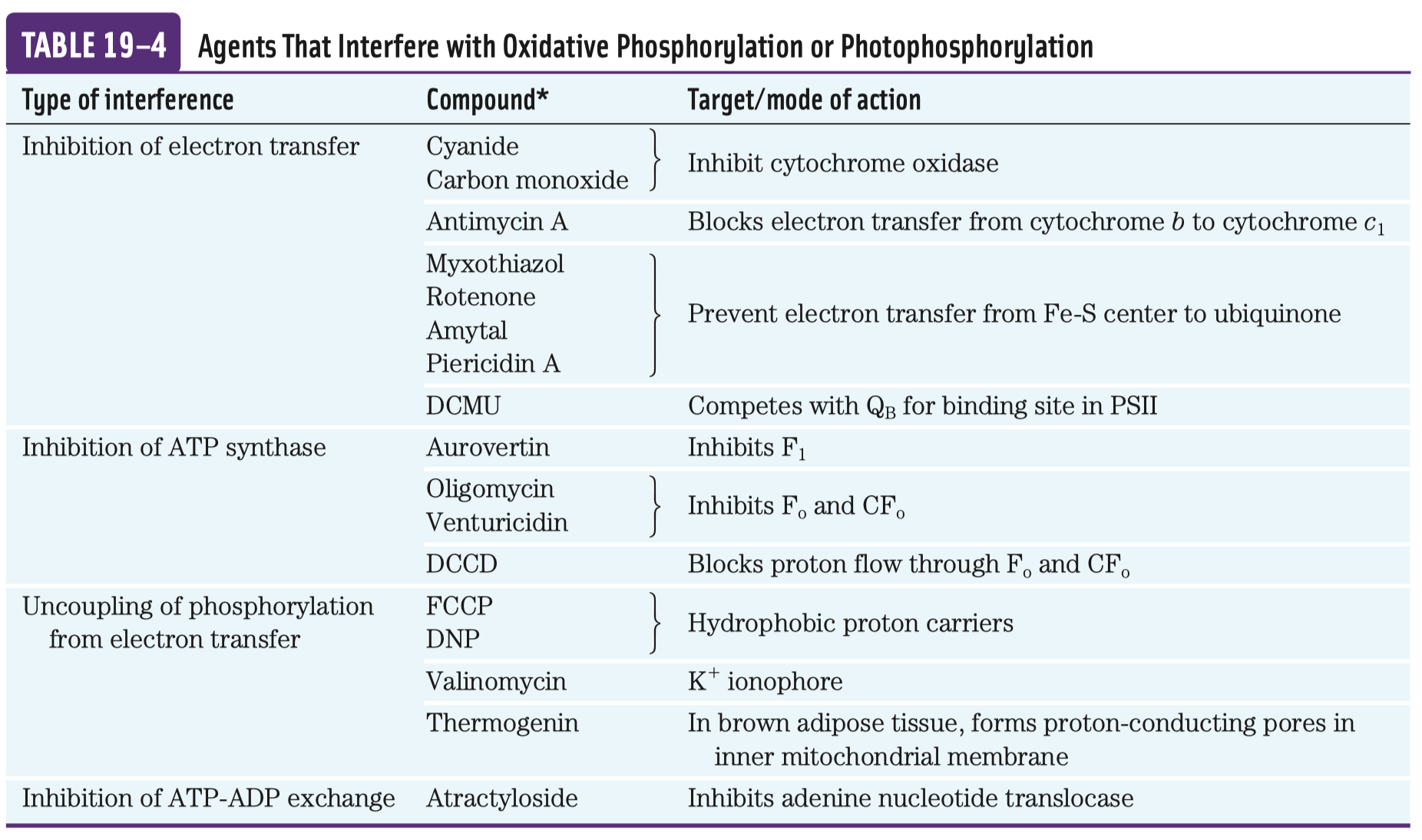
- kromě výše uvedených ještě malonát, což je inhibitor kompetující se sukcinátem
- objevil ho Krebs
- protonofory (FCCP, dinitrofenol)
- hydrofobní molekuly, které se mohou protonovat
- mimo membránu se protonují, poté vstoupí do matrix a depronují se, čímž zničí protonový gradient
- umí rozpřáhnout oxidaci a fosforylaci
- používají se v experimentech, ale i v těle, kde mají podobu proteinů vnitřní
mch membrány fungujících jako kanál- vybíjejí protonový gradient \(\rightarrow\) netřesová termogeneze (termogenin v tabulce výše)
- u člověka to umí jen děti těsně po narození, u savců jen při hibernaci
- děje se to v hnědé tukové tkáni
- u člověka mezi lopatkami a v břišní dutině
- obsahují hodně cytochromů–pohybují se v absorpci světla cca
\(\pu{500}\) až\(\pu{600 nm}\) - slouží při adaptaci na změnu okolní teploty, slouží jako ohřívač krve vedoucí k mozku a dalším orgánům
- buňky mají elektron-transportní řetězec končící rozpřahujícím proteinem
- kanály jsou přísně regulované, jsou aktivovány mastnými kyselinami a inhibovány nukleotidy
Reoxidace glykolytického NADH
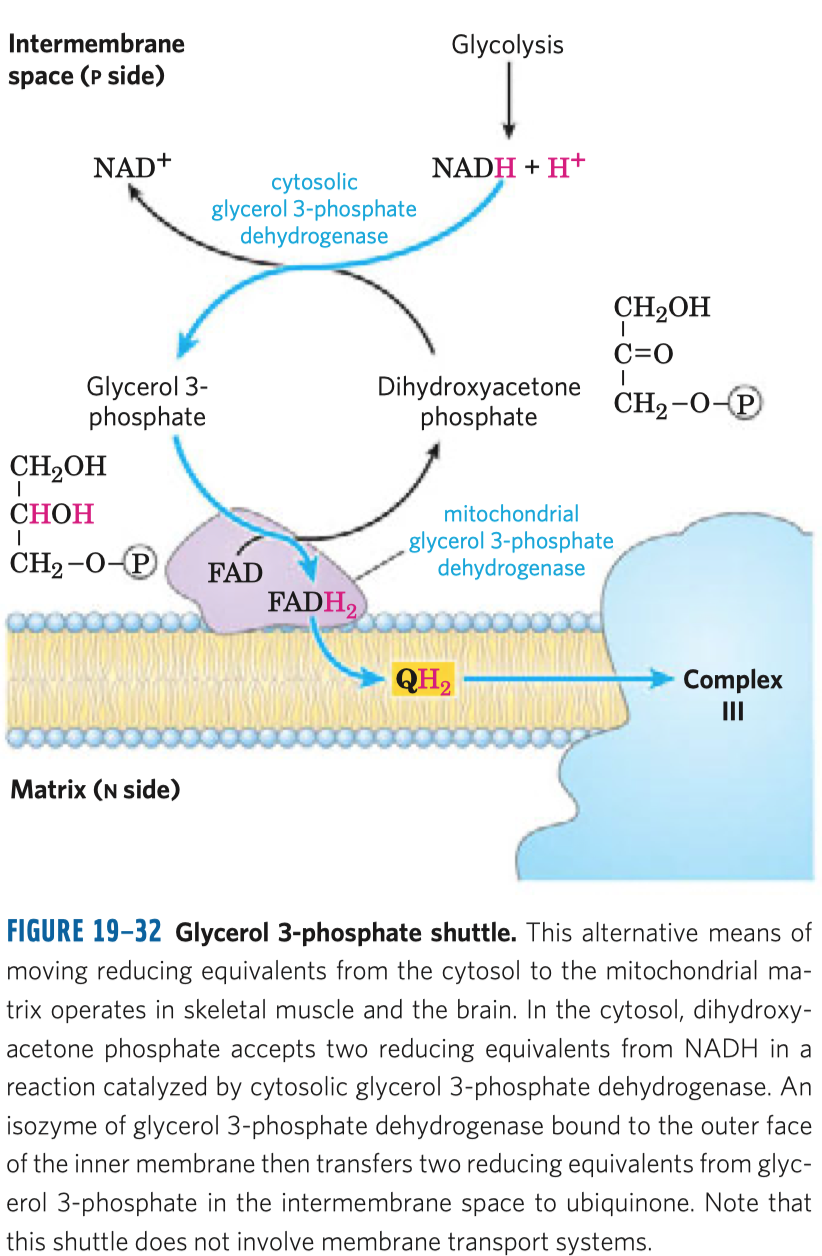
- využívá různě orientované izoenzymy
- průběh viz obrázek
- pozn. NADH je využito na redukci dihydroxyacetonfosfátu v enolázové reakci (hexóza \(\implies\) dvě triózy) a pak je zas
mch dehydrogenázou reoxidováno
- pozn. NADH je využito na redukci dihydroxyacetonfosfátu v enolázové reakci (hexóza \(\implies\) dvě triózy) a pak je zas
- nevýhoda: FAD přeskočí komplex I, čili zbytečně přijdeme o 4 protony
- Izoenzymy
- Izoenzymy jsou enzymy, které katalyzují stejnou reakci, ale mají odlišnou strukturu.
U člověka je častější následující cyklus.
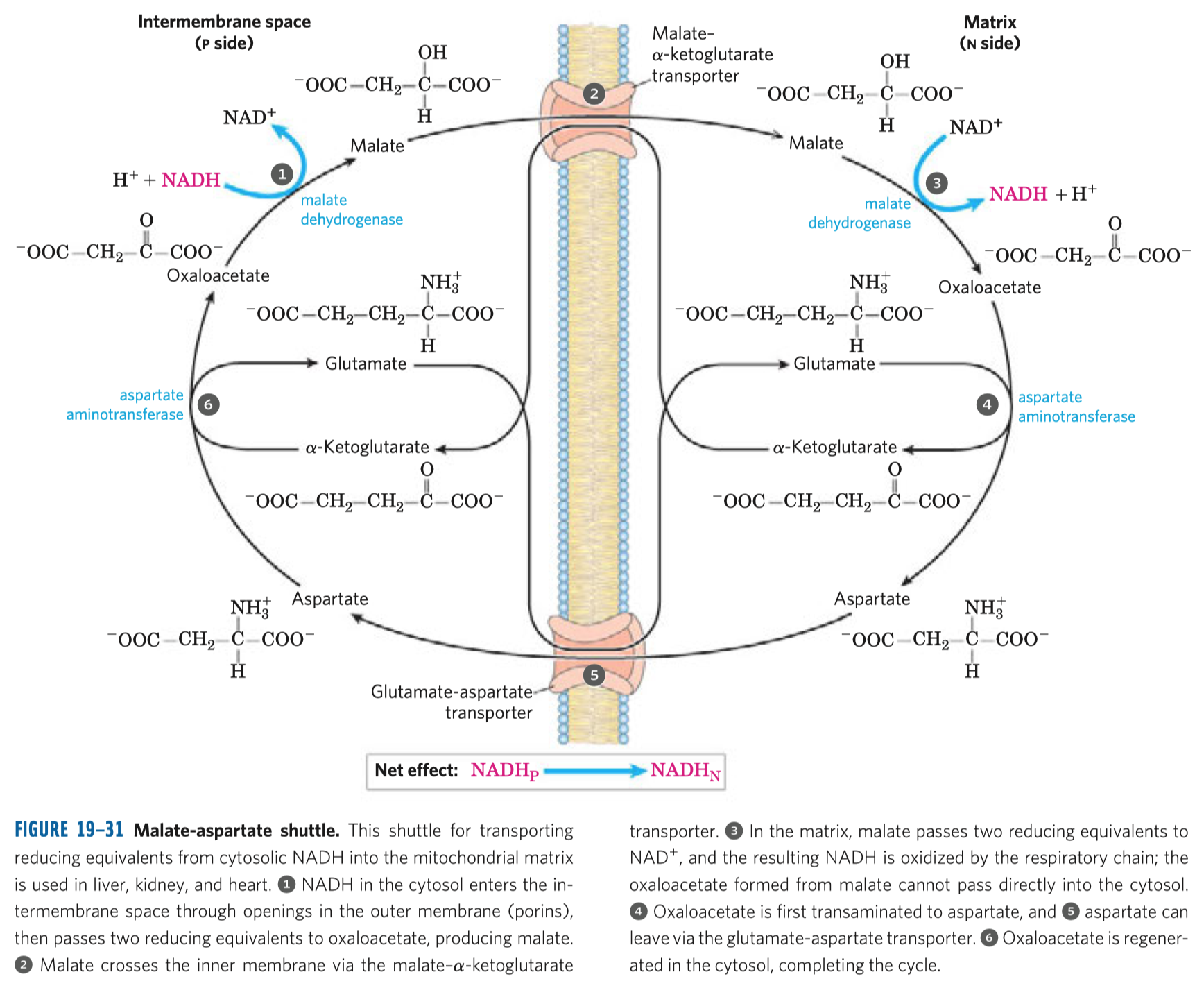
- přenos redukčních ekvivalentů je zabezpečen dvěma izoenzymy malát-dehydrogenázy
- zbytek viz obrázek (stačí znát základní cyklus, který je pod obrázkem v bodech popsán)
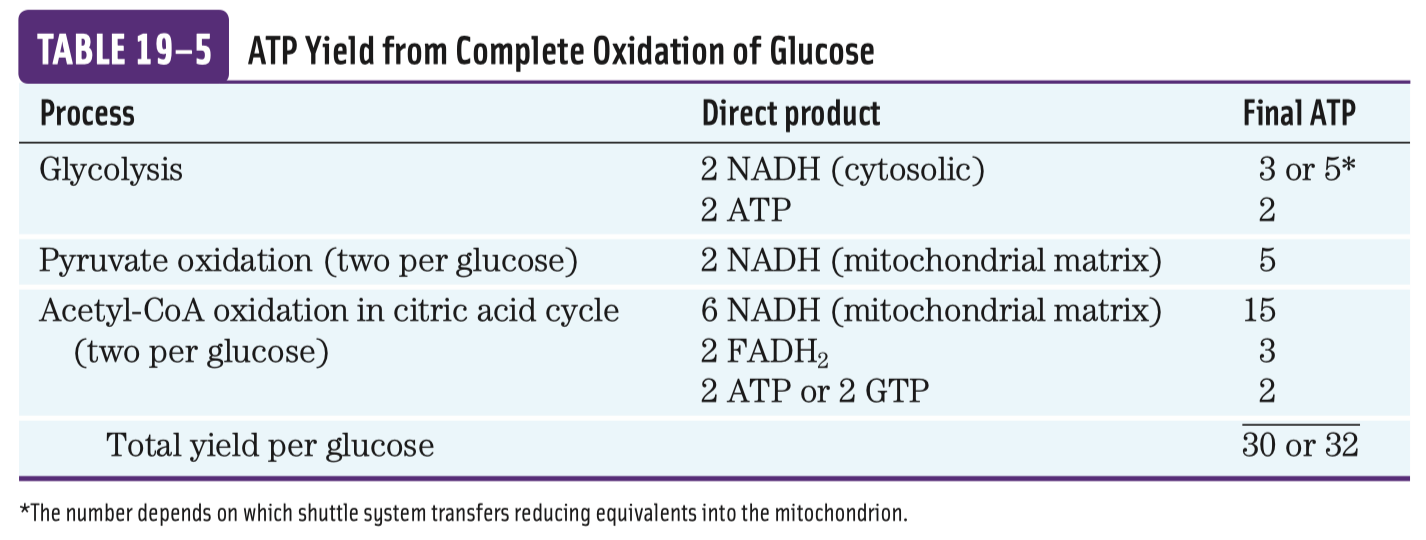
Regulace OF
- typicky regulace produktem (aby se nehromadil)
- hexokinázová reakce, pyruvátdehydrogenázový komplex
- často jsou také enzymy aktivovány či inhibovány molekulami informujícími o tom, jak je na tom buňka energeticky
- dostatek energie \(\rightarrow\) hodně NADH a ATP \(\rightarrow\) inhibice nějakých kroků
- nedostatek energie \(\rightarrow\) hodně ADP, anorganického fosfátu a neredukovaných koenzymů \(\rightarrow\) stimulace nějakých kroků
Fotosyntéza
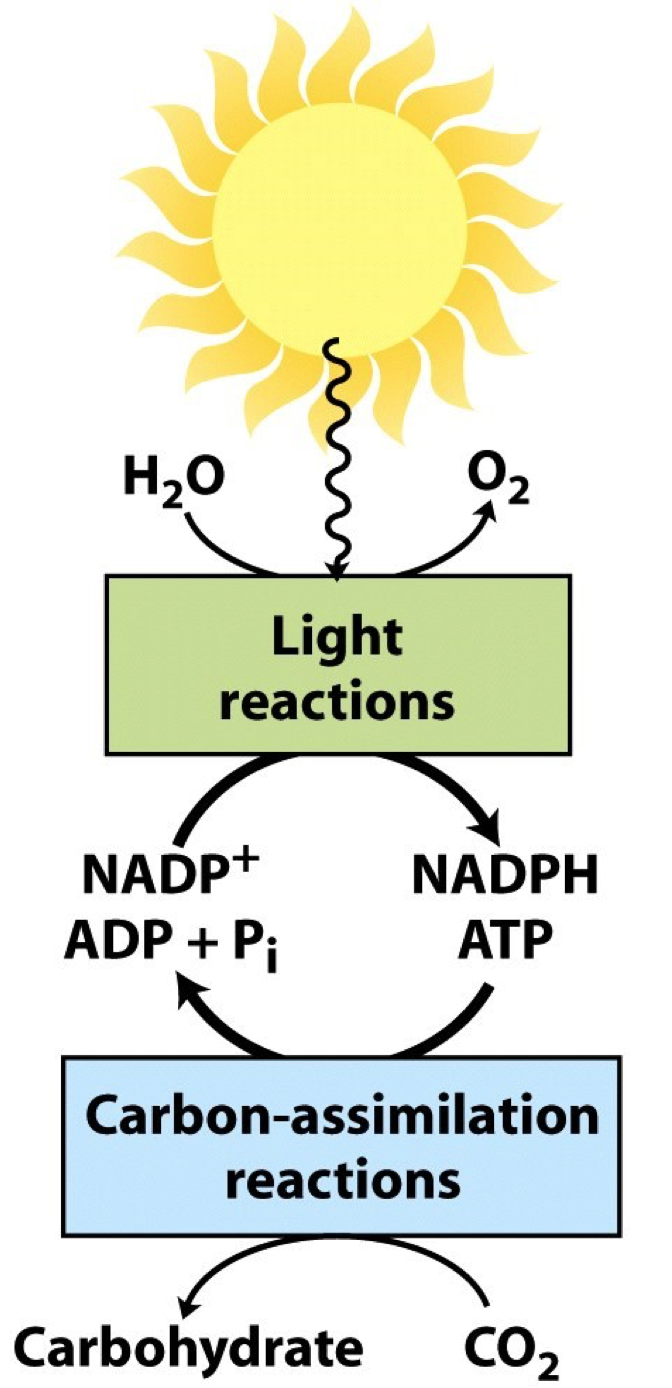
- probíhá v řasách i vyšších rostlinách
- jedná se o redoxní reakci (jako OF), pořebuje ale vytvořit dobrého donora a akceptora elektronů
- má dvě fáze, světelnou a temnostní (na obrázku výše carbon-assimilation reactions)
- temnostní ale reálně ve tmě také neprobíhá, přestože sama s fotony neoperuje—je totiž závislá na produktech světelné fáze
Obecná reakce fotosyntézy vypadá následovně:
voda zde předává elektrony (v podobě vodíku) a redukuje
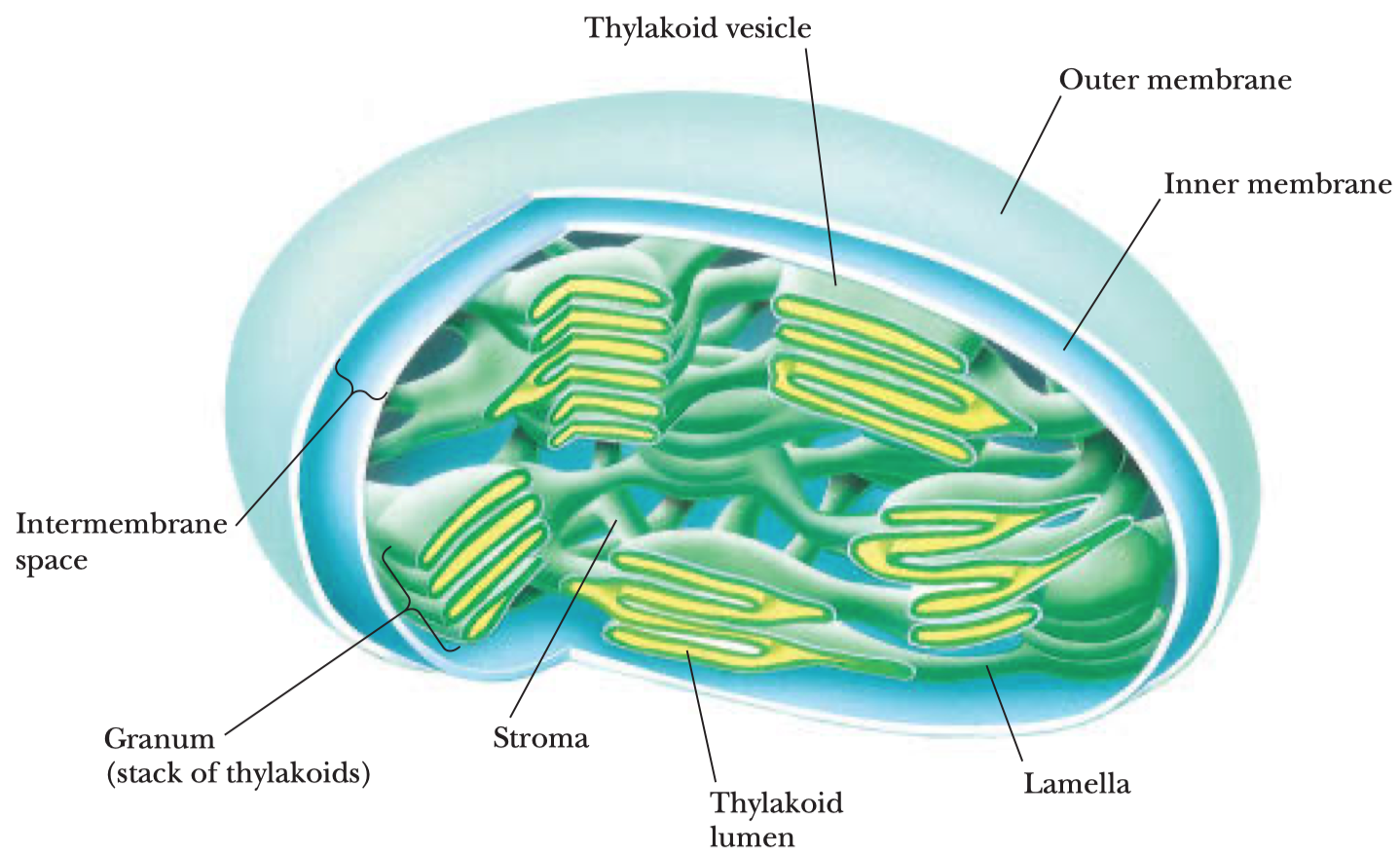
- v lamelách (membránách tylakoidů) jsou
fs pigmenty - ve stromě je většina enzymů, které jsou potřeba k
fs - Robert Hill přišel na to, že po osvícení produkují výtažky z listů
\(\ce{O2}\) a že redukují elektronový akceptor (Hillův reagens)- jeden z akceptorů při redukci měnil barvu, takže šla dobře sledovat
Světelná fáze
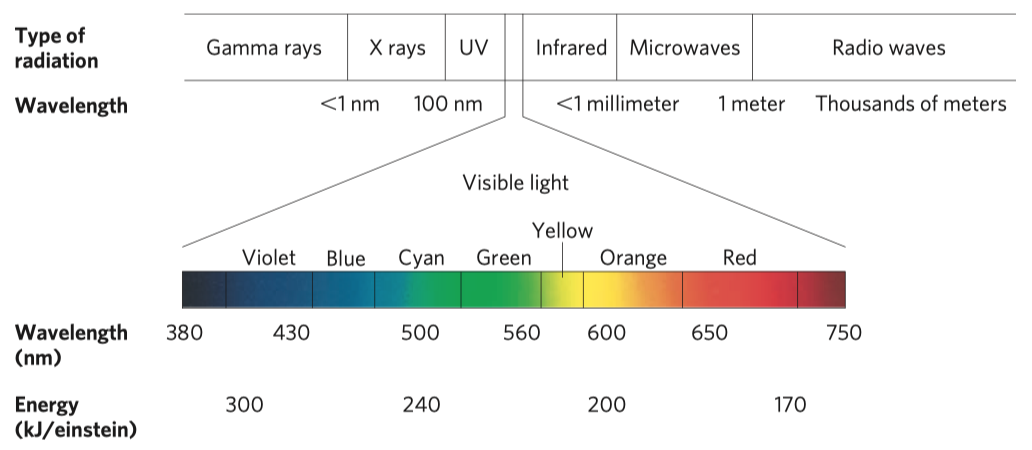
- po dopadu fotonu je excitován elektron
- energie fotonu musí přesně odpovídat rozdílu energie mezi dvěma stavy elektronu
- elektron po chvíli přechází do původního stavu
- energii vyzáří jako světlo (fluorescence), teplo, nebo ji vydá v nějakém chemickém ději
- nejdůležitější pigmenty absorbující světlo
- struktura podobná protoporfyrinu z hemoglobinu, uprostřed je ale
\(\ce{Mg^{2+}}\) - koordinován dusíky
- všechny mají dlouhý fytolový řetězec
- úseky se střídajícími se jednoduchými a dvojnými vazbami vykazují silnou absorbci ve viditelném spektru
- všechny rostliny mají A i B (v poměru cca 2:1), absorbují totiž v různých spektrech (viz obrázek níže)
- bakterie a červené řasy místo nich používají fylocybiny
- jsou často používány s doplňkovými proteiny (karotenoidy), které rozšiřují hlavní absorbční spektrum
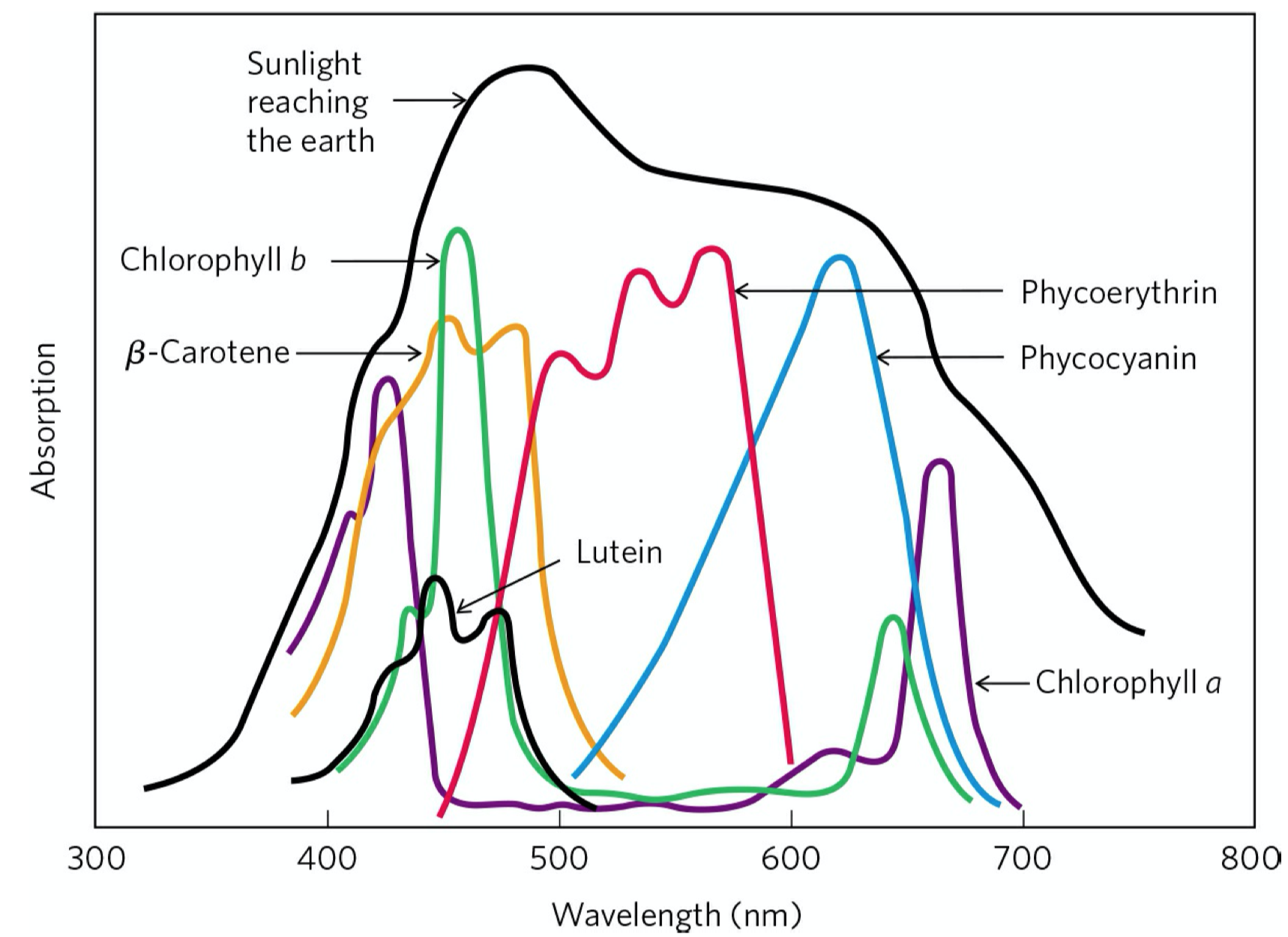
Cholorofyly vždy tvoří ještě s dalšími proteiny tzv. light-harvesting complex.
- oxygenní fotosyntéza je velice důležitá pro život na zemi, vznikla před cca 2.5 miliardami let
- nejen proto, že z anorganických sloučenin vyrábí organické, ale také proto, že uvolňuje kyslík
- chloroplasty vznikly nejspíše endosymbiózou, jako
mch - konkrétně endosymbiózou cyanobakterií
- mají své DNA, transkripční a translační mechanismy, umí se dělit
- část proteinů je ovšem importována z cytoplazmy
- cyanobakterie samotné mají jak fotosystém I, tak fotosystém II
- zdá se, že u nich došlo ke kombinaci genetického materiálu dvou různých typů bakterií
Více než polovinu veškeré fotosyntetické aktivity obstarávají mikroorganismy, mnoho z nich však není oxygenních (jako donor nepoužívají
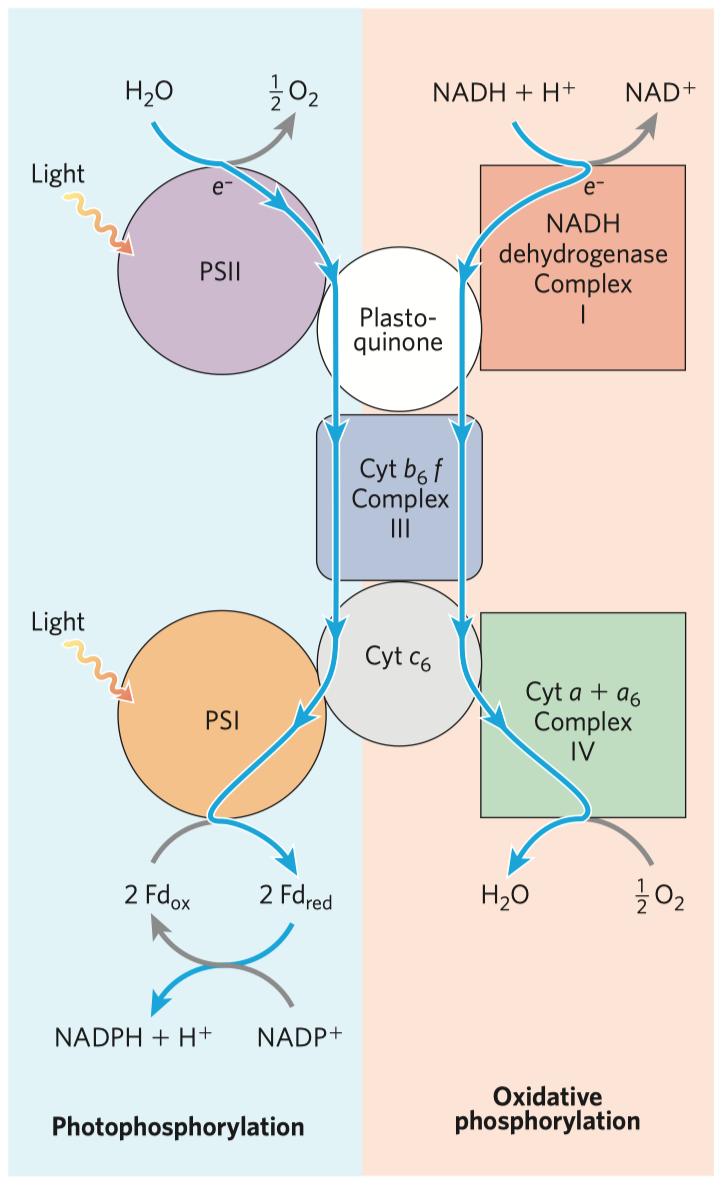
- moderní cyanobakterie umí obojí
- cyanobakterie mají tři proteiny, které se účastní obou procesů \(\implies\) oba procesy jsou nejspíše příbuzné
Halofilní archea vyvinula jiný způsob pumpování protonů přes membránu; používají bakteriorodopsin (který obsahuje retinal, derivát vitamínu A). Po jeho osvícení dojde k fotoizomeraci (protein změní tvar), při návratu do původního stavu se přenese proton. Jedná se o nejmenší protonovou pumpu, která byla objevena (247 AK).
Tok elektronů
- Exciton
- Kvantum energie přenášené z jedné molekuly na druhou, podobně jako foton je kvantum energie přenášené jako světlo.
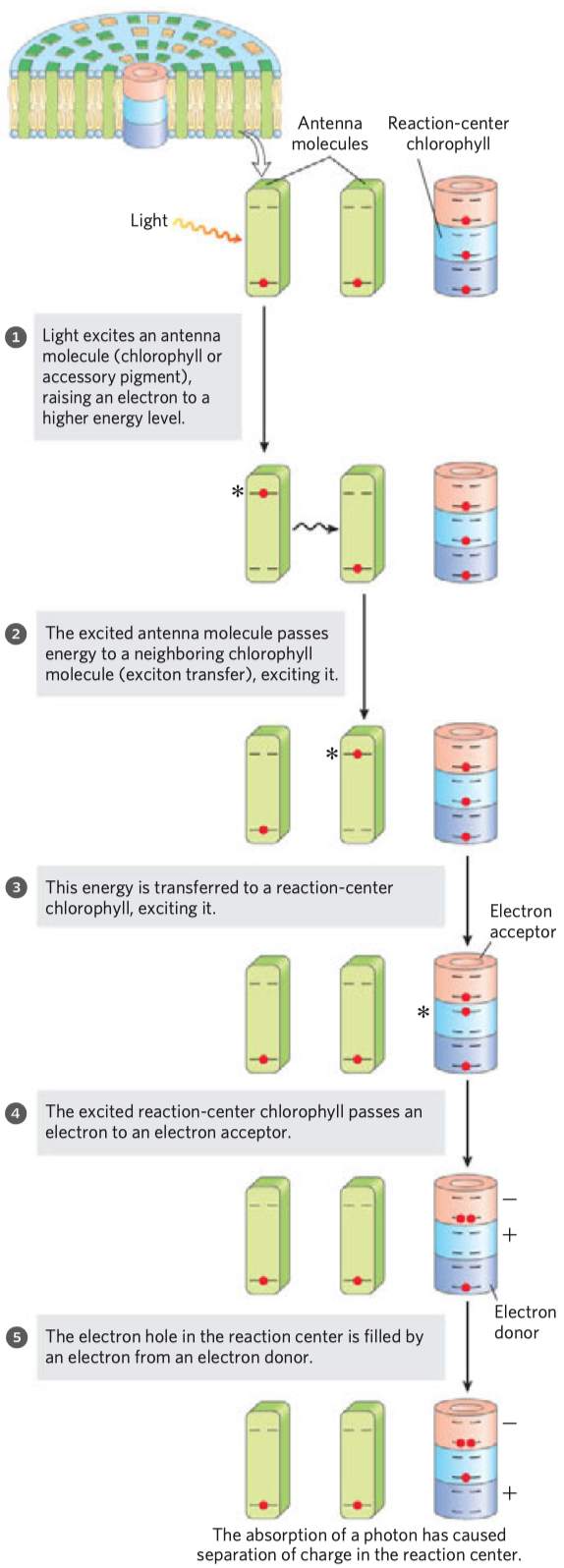
Jak obecně probíhá celá absorbce světla lze vidět na obrázku výše.
- světelný impuls o konkrétní vlnové délce způsobil, že bakterie následně chvíli na této vlnové délce absorbovaly méně
- bylo to tím, že fotochemické reakční centrum ztratilo elektron a muselo se znovu “nabít”
- byly objeveny tři základní pigmenty a pojmenovány podle toho, na jaké vlnové délce byl efekt nejsilnější: P870, P680 a P700
- liší se pro purpurové bakterie, chlorobi (zelené sirné bakterie) a pro rostliny+cyanobakterie
Purpurové bakterie a chlorobi
- reakční centrum P870, cytochrom-BC1 elektron-transferový komplex (podobný komplexu III v OF) a ATP syntáza (podobná té v
mch ) - cesta elektronu: feofytin \(\rightarrow\) koenzym Q \(\rightarrow\) cytochrom-BC1 komplex \(\rightarrow\) přes cytochrom C2 zpět do reakčního centra
- cytochrom-BC1 komplex generuje protonový gradient, který pohání ATP syntázu
- reakční centrum P840, zbytek modulů je stejný
- elektron je na cytochrom BC1 komplex přenášen jen koenzymem Q
- některé elektrony putují přes ferredoxin na ferredoxin:NAD reduktázu, která produkuje NADH
- tyto elektrony se “ztratí” a musí být v reakčním centru nahrazeny přes oxidaci
\(\ce{H2S}\) —to je reakce typická pro zelené sirné bakterie
- tyto elektrony se “ztratí” a musí být v reakčním centru nahrazeny přes oxidaci
Rostliny
- spolupráce dvou fotosystémů (FSI a FSII)
FSII je podobný systému v purpurových bakteriích, má přibližně stejně chlorofylu A a BFSI je podobný systému v chlorobech, má více chlorofylu A než B
- elektron z vody je nutné excitovat nadvakrát, aby byl schopen redukovat
\(\ce{NADP+}\) - cyklický a acyklický průběh (viz obrázek)
- cyklický generuje spíše ATP (protonový gradient)
- acyklický generuje spíše NADPH
- elektron ztracený v acyklické cestě se nahrazuje lýzou vody
- podobně jako se u chlorobů nahrazoval lýzou
\(\ce{H2S}\) - u tohoto se uvolňuje kyslík, jde o oxygenní fotosyntézu
- podobně jako se u chlorobů nahrazoval lýzou
- protonový gradient vzniká při rozkladu vody a při průchodu elektronu komplexem cytochromu B6F
- vazebné místo pro
\(\ce{PQ_B}\) je častým cílem herbicidů
Zápis celé reakce je pak
z toho na
Fotofosforylace
- velice podobná průběhu fosforylace v
mch - reakční centra, přenašeče elektronů a ATP syntáza jsou v membráně tylakoidů, která je neprostupná pro protony
- fotofosforylaci lze zablokovat stejnými látkami, které blokují fosforylaci v
mch (např. ventrucidin) - syntéza ATP je katalyzována
\(\ce{F_OF1}\) komplexy, které jsou podobné těm vmch
- přenašeče elektronů v
FSI aFSII jsou v membráně orientovány tak, aby dovnitř tylakoidů byly pumpovány protony - za každé čtyři elektrony (tedy jednu molekulu
\(\ce{O2}\) ) se přepumpuje asi 12 protonů, což je cca 3ATP
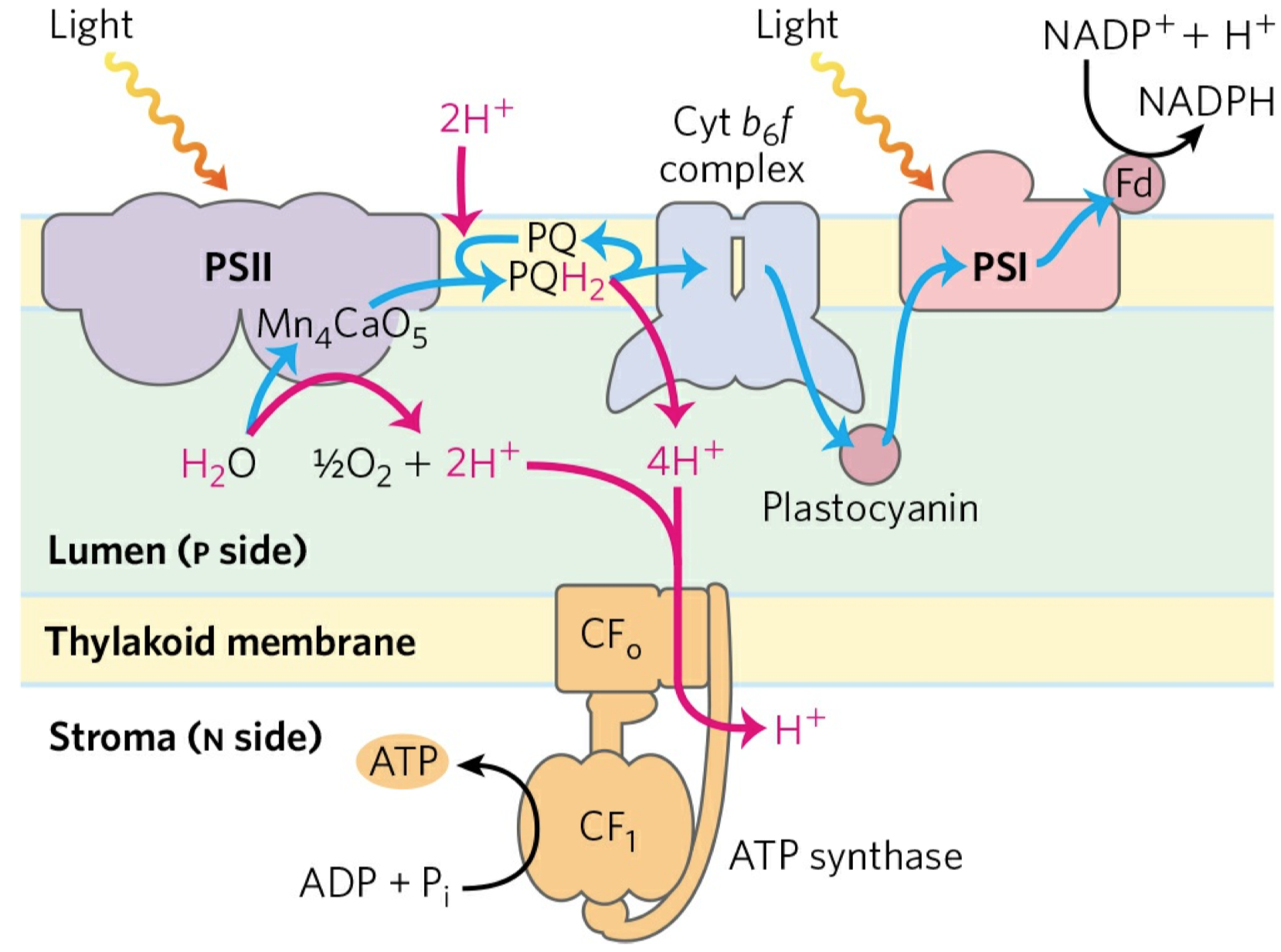
- velice podobná ATP syntáze v
mch , liší se pouze orientací- v
mch je P strana v mezimembránovém prostoru, zatímco v chroloplastech je uvnitř tylakoidu (viz obrázek níže)
- v
- podjednotky
\(\ce{CF_O}\) a\(\ce{CF1}\) (C jako chloroplast) - mechanismus je prakticky stejný jako v
mch - ATP syntáza špenátu má 14 C podjednotek, tedy nejspíše má i menší “výkon” než savčí ATP syntázy s méně podjednotkami
Biosyntéza sacharidů v rostlinách
- probíhá redukce
\(\ce{CO2}\) a jeho asimilace do jednoduchých organických sloučenin - klíčové enzymy jsou kromě fosforylace a alosterické regulace regulovány redukcí disulfidických můstků elektrony z
FSI a změnami pH a koncentrace\(\ce{Mg^{2+}}\)
- samorozmnožující se organely s dvojitou membránou
- řadí se sem chloroplasty, proplastidy a amyloplastidy (nemají tylakoidy, zato mají granula plná škrobu)
- většina biosyntetické aktivity, včetně asimilace
\(\ce{CO2}\) , probíhá v plastidech - kódují některé své proteiny, většina je z jádra
- většina enzymů nutných k asimilaci
\(\ce{CO2}\) je v chloroplastech ve stromě
Temnostní fáze, neboli asimilace
- tři fáze
- 5C + 1C \(\rightarrow\) dvě 3C
- dvě 3C molekuly jsou redukovány na dvě 3C-H
- z 3C-H je buďto regenerována původní 5C molekula, nebo je přetvořena dalšími reakcemi na hexózu
- za každých 6 vzniklých 3C-H (tedy tři běhy cyklu) se pět použije na regeneraci tří původních 5C molekul a jedna 3C-H se uvolní a použije se k syntéze hexózy
- na tři běhy je tedy výtěžek jedna 3C molekula
Za tři otáčky se promění tři molekuly
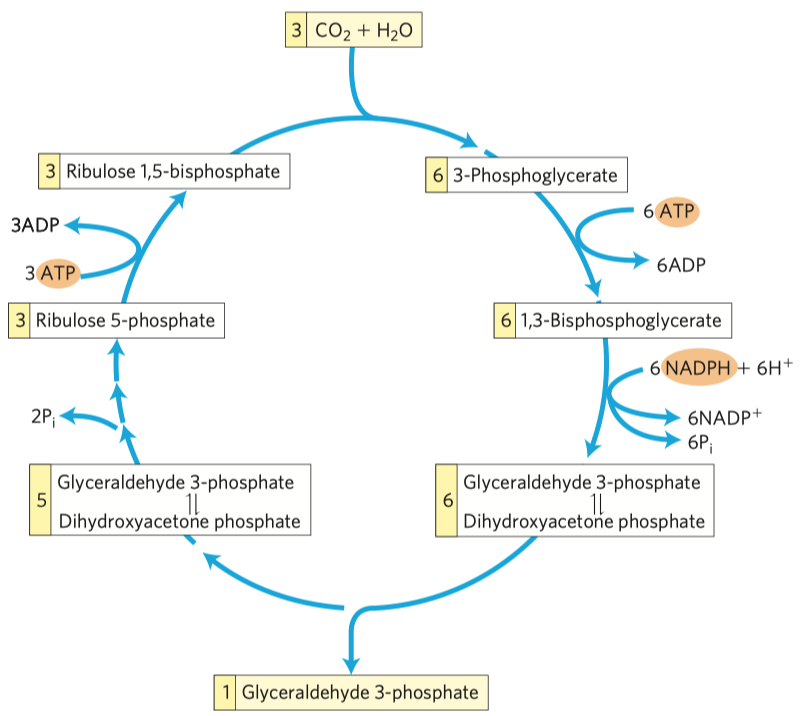
První fáze
R15BP +\(\ce{CO2}\) \(\rightarrow\) 3-fosfoglycerát- 3-fosfoglycerát je
\(\ce{C3}\) molekula, proto se těmto rostlinám říká\(\ce{C3}\) rostliny - reakci katalyzuje ribulóza-1,5-bisfosfát-karboxyláza/oxygenáza, neboli rubisco
- katalyzuje připojení
\(\ce{CO2}\) i následné štěpení nestabilní 6C molekuly - rubisco I je v cévnatých rostlinách, řasách a cyanobakteriích, rubisco II je v určitých fotosyntetických bakteriích
- je pomalý, fixuje tři molekuly
\(\ce{CO2}\) za sekundu \(\implies\) rostliny jej musí mít velké množství - rubisco I se skládá z osmi malých a osmi velkých podjednotek
- klíčovou roli hraje karbamoylovaný Lys a
\(\ce{Mg^{2+}}\)
- karbamoylace Lys je hlavní regulační bod rubisca, provádí ho rubisco aktiváza, naopak inhibuje ho
R15BP - někdy je inhibován i nočním inhibitorem (2-karboxyarabinitol-fosfát), který některé rostliny v noci produkují
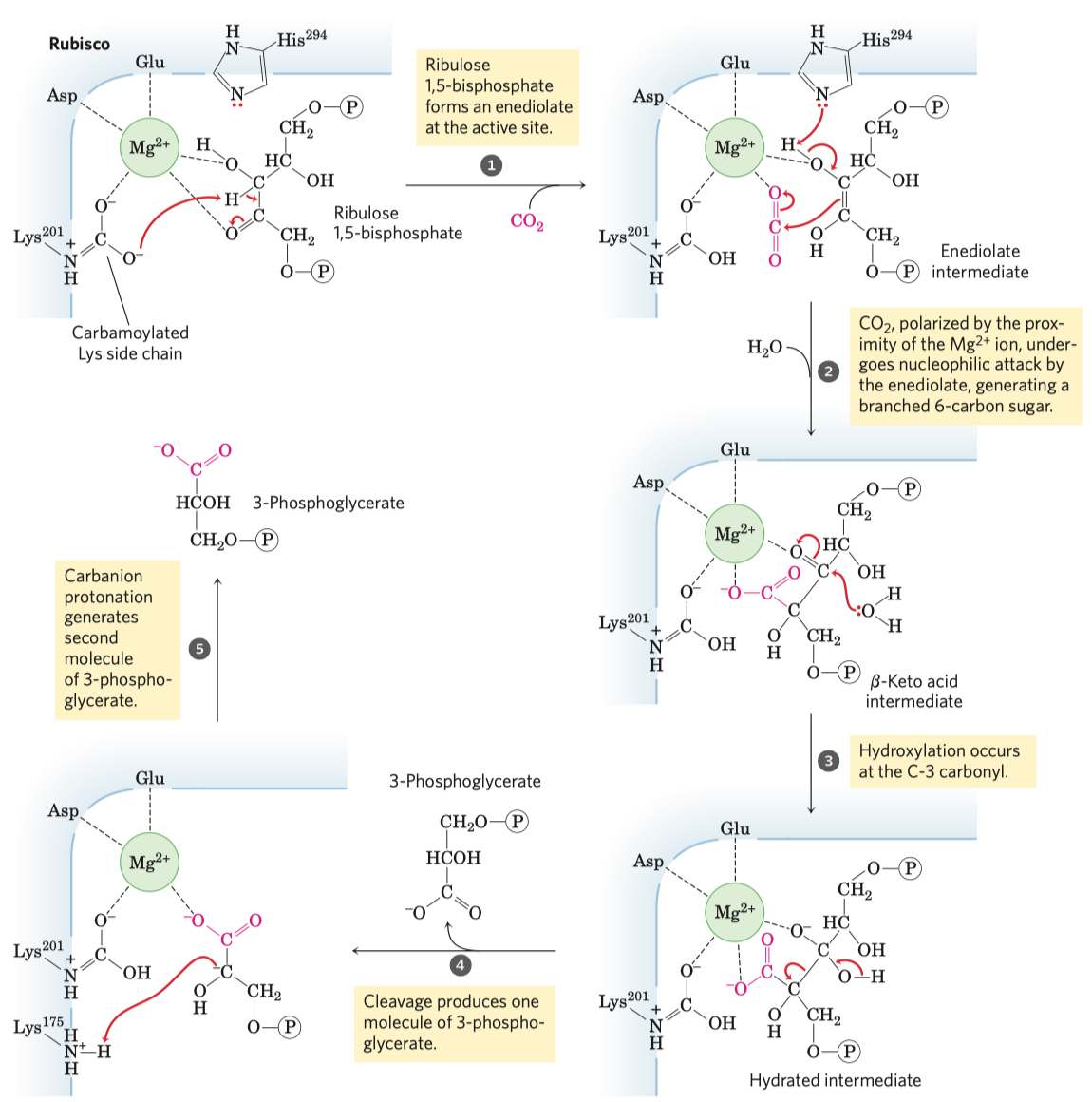
Druhá fáze
- 3-fosfoglycerát \(\rightarrow\) glyceraldehyd-3-fosfát \(\rightarrow\) případně dihydroxyaceton-fosfát
- další osudy trióz jsou znázorněny a popsány na obrázku
- podobná příslušným reakcím v glykolýze, ale naopak
- redukčním kofaktorem je ale NADPH místo NADH
- stroma obsahuje všechny glykolytické enzymy (kromě fosfoglycerát-mutázy), jsou ale kódované jinými geny; jsou to tedy izozymy
- detaily reakce (enzymy, intermediáty) viz červená šipka na obrázku
- reakce běží v tomto směru díky vysoké koncentraci NADPH ve stromě
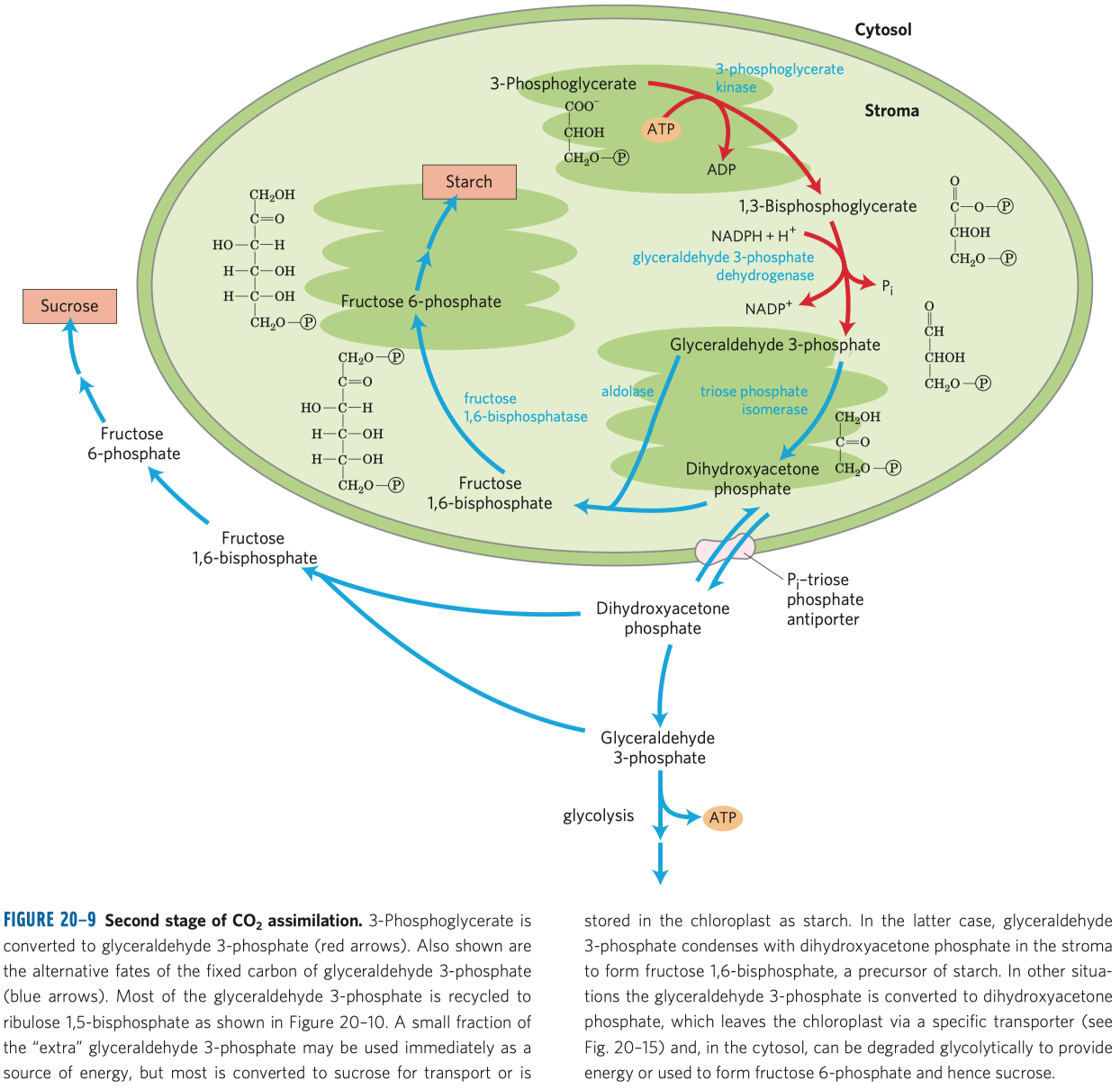
Třetí fáze
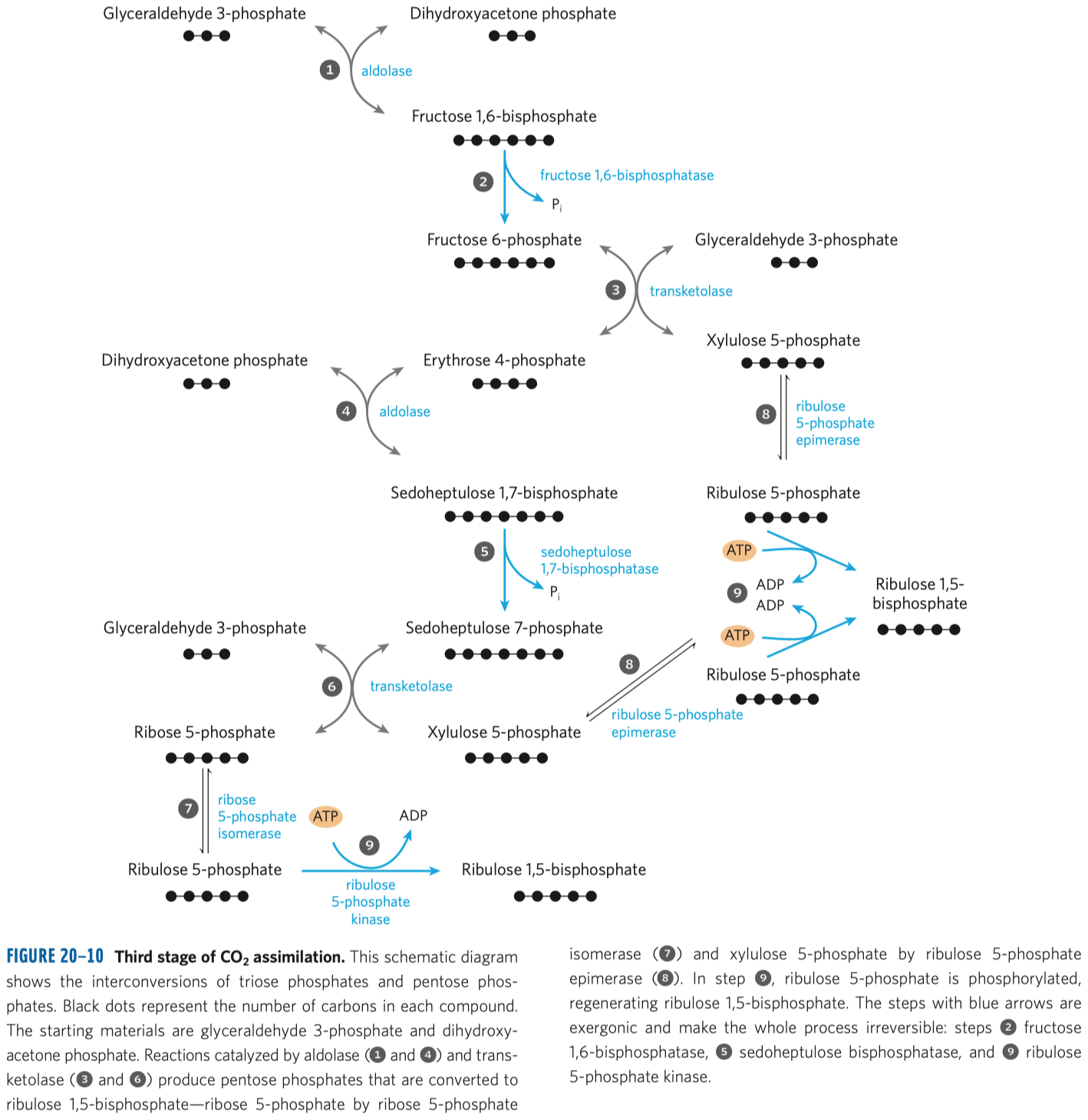
- regenerace
R15BP z trióz - intermediáty zahrnují 3C, 4C, 5C, 6C a 7C cukry (viz obrázek)
- některé kroky jsou ireverzibilní (na obrázku vyznačeny modře), protože jsou exergonické
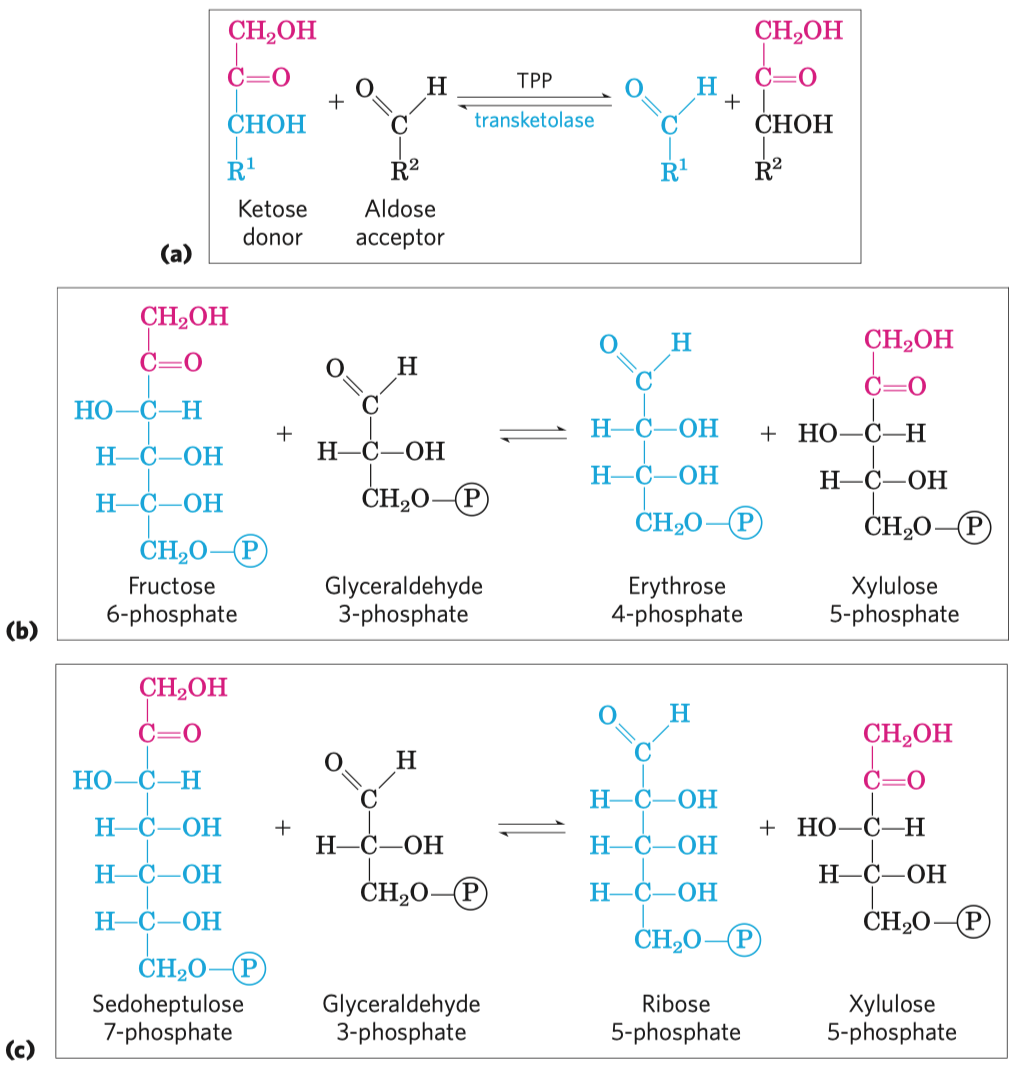
Další metabolické dráhy cukrů
Metabolismus glykogenu
- glykogen je zásobním polysacharidem živočichů,
- proč se vůbec využívá, když tuky poskytují dvakrát více energie
- získání energie z polysacharidů je rychlejší než z tuků
- z glykogenu lze získávat energii anaerobně
- odbouráváním glykogenu vzniká glukóza, která se může podílet na udržování hladiny glukózy v krvi a může být dodávána do tkání
- v buňkách se nachází v cytoplasmatických granulích o velikosti
\(\pu{10}\) až\(\pu{40 nm}\) , u obratlovců převážně na dvou místech- v játrech: glykogen může tvořit až 10 % hmotnosti jater, množství glykogenu v játrech závisí na stavu nasycenosti organismu (při hladovění klesá)
- ve svalech: může tvořit 1–2% hmotnosti svalu. Množství nesouvisí ani tak s nasyceností, jako s trénovaností (člověk je trénovaný \(\rightarrow\) množství glykogenu ve svalech roste)
- svalů je ale více než jater, takže v absolutních číslech je glykogenu nejvíce ve svalech
- dále se malé množství nachází v mozku
- stejná jako struktura amylopektinu
- skládá se z glukózových podjednotek propojených α1\(\rightarrow\)4 glykosidickými vazbami, v místě větvení jsou α1\(\rightarrow\)6 glykosidické vazby
- glykogen je větven hustěji než amylopektin, protože živočichové potřebují mobilizovat energii rychleji než rostliny
- jednotky mohou být odbourávány na všech větvích současně
- 50% glukózových podjednotek ve struktuře se nachází před prvním místem větvení
- vždy má pouze jeden redukující konec
Odbourávání glykogenu
První reakce
- prvním a zároveň nejdůležitějším enzymem odbourávání glykogenu je glykogenfosforyláza
- dimer, každý z monomerů má C’ a N’ terminální doménu
- hlavní regulační enzym odbourávání glykogenu
- má důležitý kofaktor, pyridoxal-5-fosfát
- pyridoxin je vitamín
\(\ce{B6}\)
- pyridoxin je vitamín
- katalytické místo
- nachází se na rozhraní mezi N a C koncovou doménou
- má též místo pro vazbu kofaktoru
- glykogen-vazebné místo
- na rozhraní N terminálních domén
- vejde se do něj 4–5 glukózových podjednotek, avšak pouze v lineárním stavu (nevětvených)
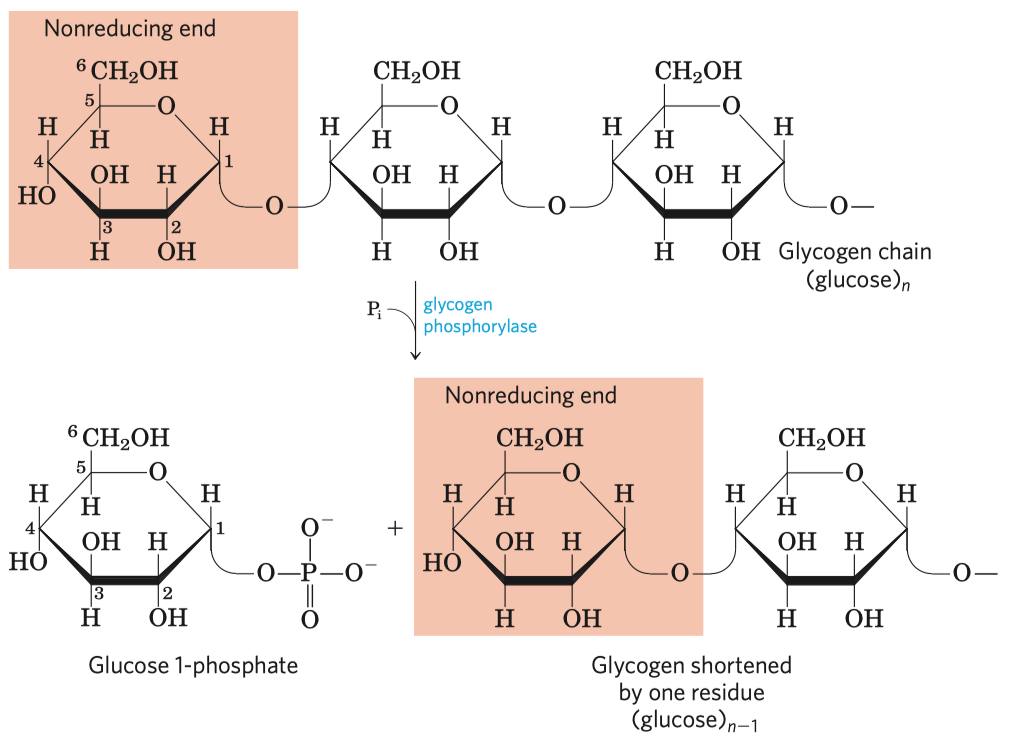
- nemusíme znát v detailu
- dochází ke štěpení glykogenu v procesu fosforolýzy
- podobné jako hydrolýza, ale místo vody je zde kyselina fosforečná
- mechanismem reakce je tedy fosforolýza škrobu, jedná se o acidobazickou katalýzu
- úloha pyridoxal-5-fosfátu v reakci je půjčovat proton zbytku kyseliny fosforečné, která štěpí vazbu mezi glukózovými podjednotkami
- funguje jako protonové relé, které v průběhu reakce půjčí proton kyselině fosforečné a na konci si ho zase odebere
- enzym je s glykogenem stále v kontaku, nemusí disociovat a resociovat po každé reakci \(\rightarrow\) urychlení
- glykogen projíždí kapsou v enzymu
Druhá reakce
Během první reakce vzniká glukóza-1-fosfát, do glykolýzy však potřebujeme glukózu-6-fosfát. O změnu z jednoho na druhé se stará druhá reakce odbourávání glykogenu.
- viz obrázek
- probíhá přes meziprodukt, kde jsou fosforylovaná obě místa: glukózu-1,6-bisfosfát
- podobnou reakci jsme probírali v glykolýze (á. reakce), kde se pomocí fosfoglycerátmutázy mění 3-fosfofglycerát na 2-fosfoglycerát
- v katalytickém centru enzymu je Ser, který váže ten extra fosfát (u glykolýzy to byl His)
Třetí reakce
- souvisí se strukturou glykogenfosforylázy, která umí zpracovat jen lineární glykogen
- když se dojde k místu větvení, nasedne linearizační enzym, který zbytky linearizuje
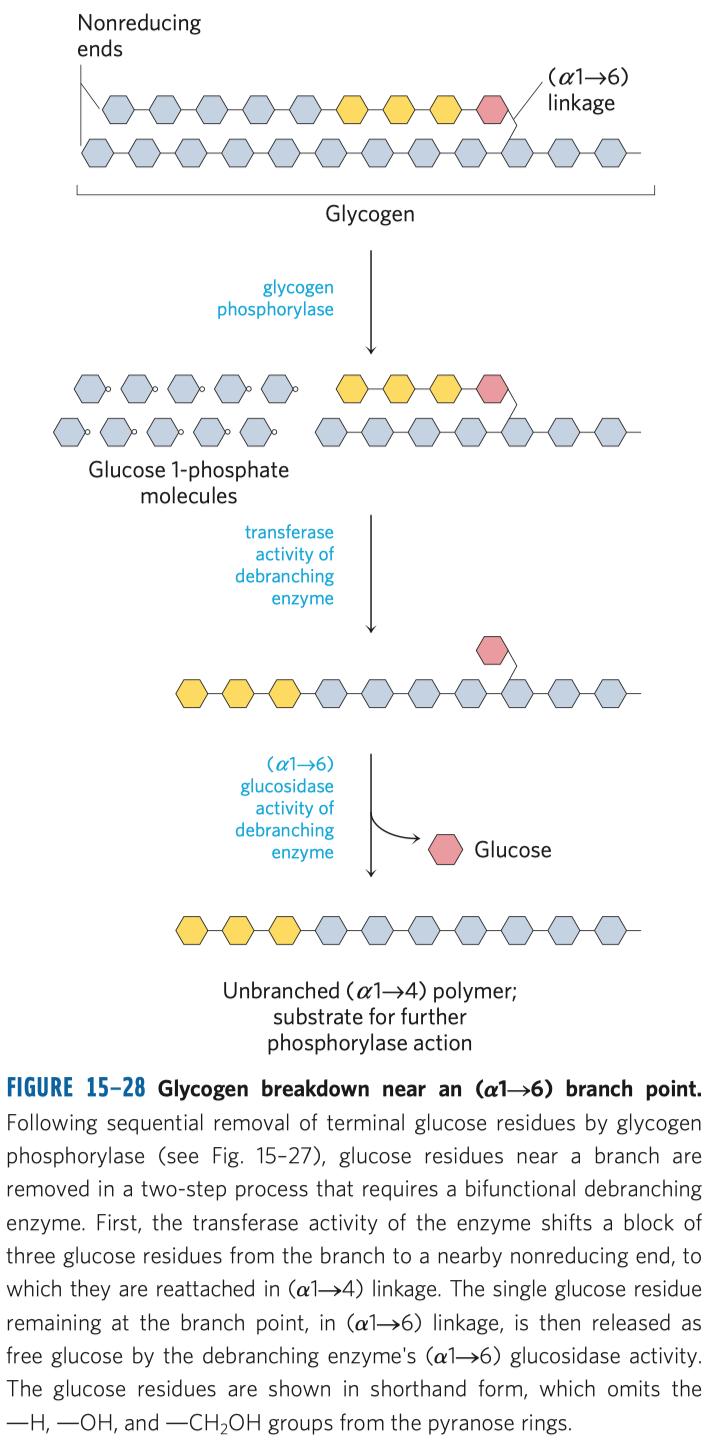
- (α1 \(\rightarrow\) 4)-transglykosylázová aktivita
- krátká část řetězce (např. na obrázku 4 jednotky, tzv. limitující systém) pospojovaného (α1 \(\rightarrow\) 4) vazbami je přesunuta
- v původní větvi zůstává už jen jedna glukóza, která je připojena na větvící místo vazbou (α1 \(\rightarrow\) 6)
- ze dvou větví vytvoří jednu delší a jednu, která má už jen jednu glukózu
- (α1 \(\rightarrow\) 6)-glukosidázová aktivita
- hydrolyzuje glukózový zbytek v místě větvení, který byl připojen (α1 \(\rightarrow\) 6) vazbou
- tento se uvolňuje jako glukóza
- změna (α1 \(\rightarrow\) 6) na (α1 \(\rightarrow\) 4) není z energetického hlediska možná, proto dochází k hydrolýze
Kolem 90% glukózy z glykogenu se uvolňuje jako glukóza-6-fosfát, zbytek pochází z míst větvení a uvolňuje se jako glukóza.
Syntéza glykogenu
První reakce
Nejprve je potřeba připravit energeticky nabitou glukózu.
- do reakce vstupuje glukóza-1-fosfát a UTP (uridintrifosfát)
- katalyzuje ji UDP-glukózadifosforyláza
- enzym je pojenovaný podle zpětné reakce
- vzniká pyrofosfát \(\rightarrow\) dělí se během reakce na dva fosfáty \(\rightarrow\) velké množství energie
- UTP je doplňováno reakcí
\(\ce{UDP + ATP -> UTP + ADP}\) , celá reakce nás tedy “stojí” jedno ATP
Druhá reakce
Aktivovaná glukóza se dále využije k syntéze glykogenu.
- glukóza se připojí na již existující řetězec (s počtem glukóz > 4), katalyzuje to glykogen syntáza
- na začátku reakce je potřeba primer, tím je hydroxylová skupina Tyr na glykogeninu
- na tu se naváže první glukózová podjednotka \(\rightarrow\) poté několik dalších \(\rightarrow\) potom už to jede pomocí glykogensyntázy
- glykogensyntázová reakce je hlavní regulační reakcí syntézy glykogenu
Třetí reakce
Poslední reakcí je opak linearizace při rozkladu glykogenu—zde máme naopak větvící reakci a větvící enzym.
- enzym amylo (α1\(\rightarrow\)4) na (α1\(\rightarrow\)6) transglykosyláza (jiným jménem glykosyl-(4\(\rightarrow\)6) transferáza)
- na dostatečně dlouhé větvi, která je tvořená (α1\(\rightarrow\)4) glykosidickými vazbami, odštěpí glukózu a přilepí ji jinde vazbou (α1\(\rightarrow\)6)
- v tomto směru je to z energetického hlediska možné
- “dostatečně dlouhá větev” = alespoň 11 glukóz a alespoň 4 podjednotky od posledního místa větvení, z prostorových důvodů
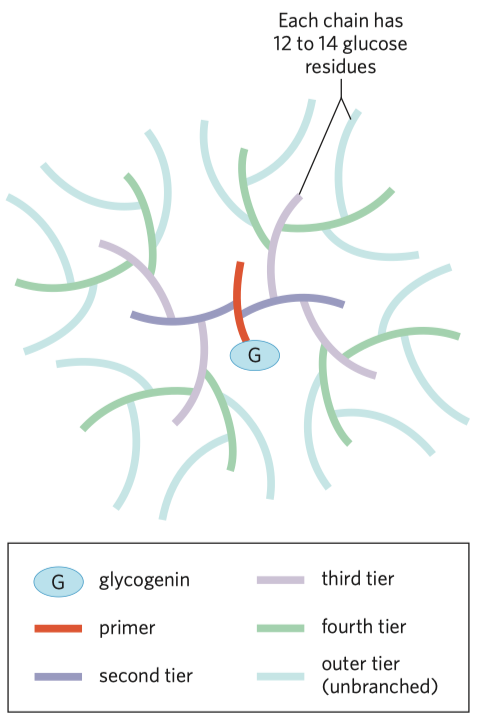
Regulace glykogenfosforylázy
- dochází jak k alosterické regulaci (na alosterickém místě), tak k regulaci posttranslačními modifikacemi
- oba druhy regulace jsou provázané
- v játrech je glykogen odbouráván tehdy, když je potřeba zvýšit hladinu glukózy v krvi
- např. při hladovění, nebo při zvýšených nárocích na svalovou práci, kterou signalizují stresové hormony
- odbourání glykogenu nemá být rovnou spřaženo s glykolýzou, má glukózu jen uvolnit do krve \(\rightarrow\) glykolýza je tedy inhibována
- ve svalech je odbouráván pro svalovou práci
- zde je odbourávání glykogenu přímo pro glykolýzu
Jak to ale zařídit?
- fruktóza-2,6-bisfosfát je nejsilnější alosterický regulátor fosfofruktokinázy, hlavního glykolytického enzymu
- ve svalech je při odbourávání glykogenu podporována tvorba tohoto produktu
- v játrech je podporováno jeho odbourávání
Alosterická regulace
- R a T forma enzymu
- Enzym v R (relaxed) formě je, alespoň v kontextu metabolismu, vždy aktivnější než enzym v T (tense) formě. Jedná se o stejný enzym, ale ve dvou stavech.
- kromě R a T má glykogenfosforyláza i A a B formu
- jediný strukturní rozdíl: A má fosforylovaný
\(\ce{Ser14}\) , B ne
- jediný strukturní rozdíl: A má fosforylovaný
- funkční rozdíly
- fosforyláza A
- aktivnější, nereaguje tolik na alosterickou regulaci
- za normálních okolností je v R stavu
- do T stavu je převedena pouze vysokou koncentrací glukózy
- fosforyláza B
- je velice citlivá na alosterické regulátory
- je inhibována vysokou koncentrací ATP či glukózy-6-fosfátu
- za normálních okolností je v T stavu
- aktivována je vysokou koncentrací AMP
- fosforyláza A
- přechod mezi A a B zajišťují dva různé enzymy
- o A \(\rightarrow\) B se stará fosfoprotein fosfatáza (neboli fosfatáza fosforylázy A)
- a B \(\rightarrow\) A zajišťuje fosforyláza-kináza (neboli kináza fosforylázy B)
- k fosforylaci či defosforylaci dochází pouze v T formách
Fosforylace Ser u A a přítomnost AMP na alosterickém místě u B podporují R formu podobným způsobem.
Regulace posttranslačními modifikacemi
- metabolismus glykogenu je regulován pomocí bicyklické kaskády
- jeden enzym aktivuje druhý a ten aktivuje třetí.
- výhody: na každém “předání štafety” je možné znásobit signál, detailněji signál regulovat atd. (zvlášť, když se přidá více úrovní než jen dvě)
- vazba hormonu na receptor
- uvolňování cyklického AMP (dále jen cAMP)
- aktivace
cAMP -dependentní kinázy (jinak též proteinkináza A, dále jen PKA) - fosforylace kinázy fosforylázy B (tím se kináza fosforylázy B aktivuje)
- fosforylace glykogenfosforylázy a glykogensyntázy
- glykogenfosforyláza A je tím aktivována, glykogen se začne odbourávat -naopak glykogensyntáza je fosforylací deaktivována
Po glukózové infuzi tedy stoupne odbourávání glykogenu a zpomalí se jeho opětovná syntéza.
Hormonální regulace metabolismu sacharidů
- pankreatické α buňky vyplaví glukagon
- ten se váže na svůj receptor na jaterní buňce, jenž je spřažen s adenylát-cyklázou \(\rightarrow\) tvoří se
cAMP (druhý posel) cAMP spustí bicyklickou kaskádu odbourávání glykogenu- glukóza se uvolňuje do krve, zvyšuje se její hladina
- glukóza přímo proniká do jaterních buněk a tam inhibuje glykogenfosforylázu (\(\rightarrow\) zabrání se štepení glykogenu)
- jaterní buňky vyplavují inzulín \(\rightarrow\) ve svalových buňkách jsou přenášeny
\(\ce{GLU4}\) (transportéry pro glukózu) z cytoplasmy na membránu- po snížení hladiny inzulínu jsou
\(\ce{GLU4}\) endocytovány zpět.
- po snížení hladiny inzulínu jsou
Snížená signalizace přes inzulínový receptor prodlužuje život u hlístice, myši i u člověka—to ukazuje na význam kalorické restrikce (i v prevenci nádorů).
Inzulínová signalizace (a signalizace přes mTOR) ovlivňuje také rozdělení včel do kast. Kombinace hormonálních a nutričních signálů vytvoří odlišné fenotypy při stejném genotypu.
- na jaterní buňku se váže adrenalin, jsou tam na něj dva (α a β) receptory
- β receptory \(\rightarrow\) adenylát-cykláza \(\rightarrow\)
cAMP \(\rightarrow\) bicyklická kaskáda - α receptory \(\rightarrow\) štěpení fosfatidyl-inozitol-trifosfátu \(\rightarrow\) inozitoltrisfosfáty a diacylglyceroly (druzí poslové, stejně jako
cAMP ) - působením inozitoltrisfosfátu se uvolňuje vápník \(\rightarrow\) aktivace kinázy-fosforylázy \(\rightarrow\) odbourávání glykogenu
- glukóza se uvolňuje do krve
- tentokrát to není proto, aby se zvýšila její hladina, ale kvůli dopravení do svalů
- aktivuje se adrenalinový receptor (svaly mají pouze β)
- adenylát-cykláza
- vznik
cAMP - odbourávání glykogenu
- ihned následuje glykolýza
Označují se jako glykogenózy a zpravidla jsou způsobeny tím, že je mutován nějaký enzym odbourávání nebo syntézy glykogenu ve svalech či játrech.
- defekt ve svalové glykogenfosforyláze
- při lehké zátěži se prudce zdvihne hladina ADP, protože svalová glykogenfosforyláza nereaguje na svalovou práci, dochází k odbourávání svalového glykogenu
- při dlouhotrvajícím cvičení je rozdíl menší, protože jsou svaly zásobeny z jaterního glykogenu
- 6 dnů před vytrvalostním závodem se omezí příjem cukrů a glykogenu v potravě
- poslední 3 dny se jich naopak konzumuje větší množství
- tělo má signalizován nedostatek a tak nejen, že doplní ten ztracený glykogen, ale ještě zvětší zásoby
Coriho cyklus
- v odpočívajícím svalu se vytváří zásoby glykogenu, v aktivním probíhá reakce měnící glykogen \(\rightarrow\) laktát
- laktát je transportován do krve, a krví do jater
- v játrech se laktát účastní glukoneogeneze, tvoří se z něj opět glukóza
Cyklus je pojmenován podle manželů Coriových, absolventů Karlovy univerzity a nositelů Nobelovy ceny.
Glukoneogeneze
- dále jen gng
- syntéza cukrů z necukrů
- cukry jsou substrát pro vznik energie, ale jsou důležité i pro další energetické substráty (např. pro zpracování tuků v KC)
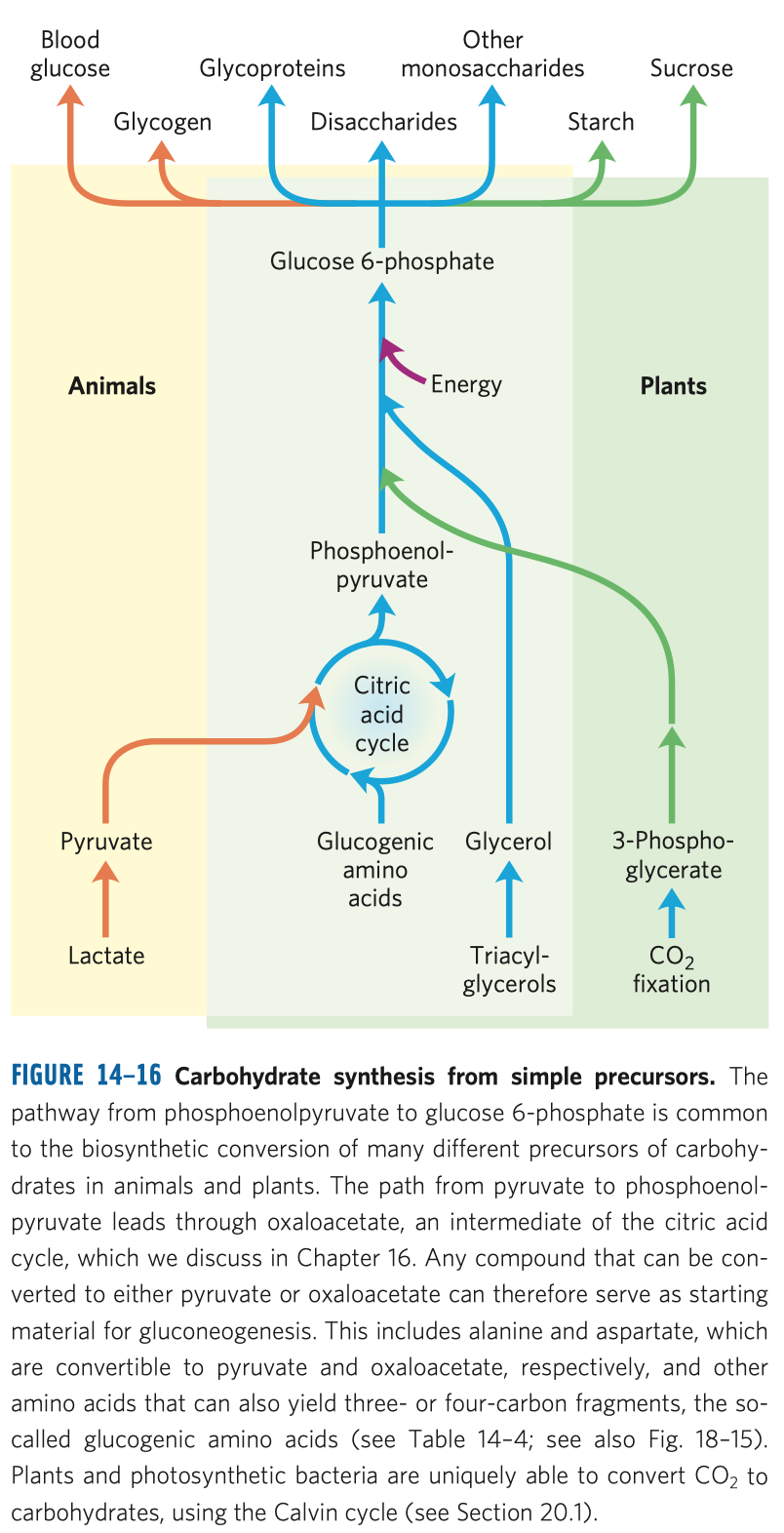
- živočichové mohou tvořit cukry z kyseliny mléčné
- rostliny z
\(\ce{CO2}\) , používají ho jako zdroj uhlíku a budují jej do kostry cukrů - střed je společný oběma: dokážou cukry dělat z triacylglycerolu (ale jen z té alkoholové části) a z glukogenních AK
- AK jsou ty, které na různých místech vstupují do KC: Ala, Arg, Asp, Cys, Glu, Gly, His, hydroxyprolin, Met, Pro, Ser, Thr, Val
- nevstupují samozřejmě samotné AK, ale AK přetvořené buďto v nějaký z intermediátů KC, nebo přímo na acetyl-CoA
- AK jsou ty, které na různých místech vstupují do KC: Ala, Arg, Asp, Cys, Glu, Gly, His, hydroxyprolin, Met, Pro, Ser, Thr, Val
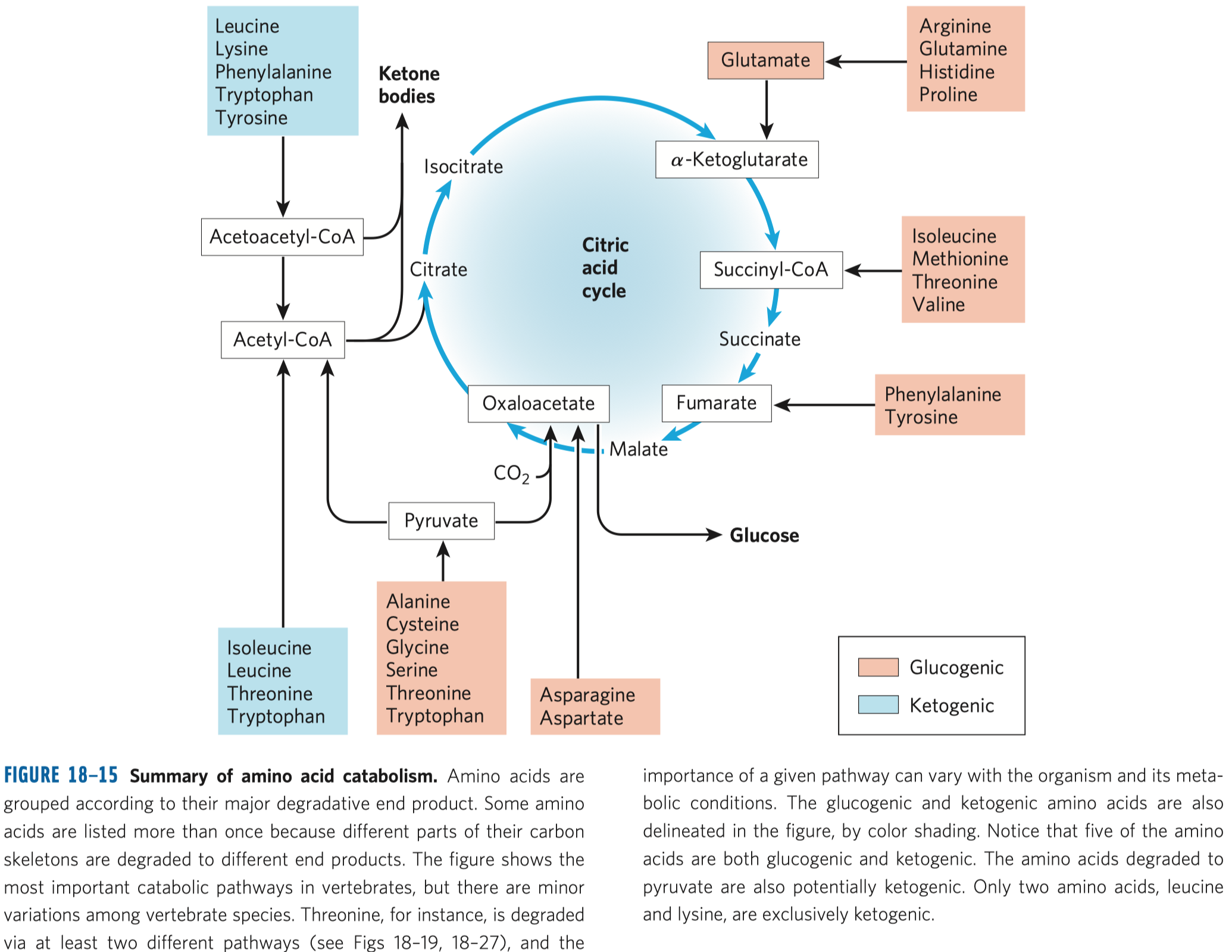
gng se mohou účastnit ty AK, které do KC vstupují až po 1. nebo 2. dekarboxylaci- v opačném případě by přišly o dva uhlíky (a žádný by tedy nezbyl na
gng )
- v opačném případě by přišly o dva uhlíky (a žádný by tedy nezbyl na
- Lys a Leu vstupují do reakce jako acetyl-CoA (tedy před oběma dekarboxylacemi) a nemohou se tedy
gng zúčastnit
- z MK sice cukry (víceméně) vznikat nemohou, ale z glycerolu (součást tuků) ano
- glycerol nám zbyde poté, co z něj lipázy odštěpí MK
- glycerol \(\rightarrow\) fosforylace na glycerol-3-fosfát \(\rightarrow\) dihydroxyacetonfosfát (viz obrázek níže, tam jsou i enzymy)
- dihydroxyacetonfosfát se pak může účastnit glykolýzy nebo
gng - v glykolýze může být v páté reakci zaměňován s glyceraldehyd-3-fosfátem, který je (podobně jako dihydroxyacetonfosfát) produktem čtvrté reakce
- malá část molekuly tuku tedy do
gng vstoupit může
Navíc, propionyl-CoA vzniklý z β-oxidace MK s lichým počtem uhlíků může vstoupit do KC, kde unikne oběma dekarboxylacím a jeho uhlíky tedy také mohou sloužit k syntéze cukru.
- reakce
gng jsou často jen obrácené reakce glykolýzy - musí se ošetřit, aby se reakce glykolýzy a
gng netočily pořád dokola (tzv. jalové cykly) - proto jsou v glykolýze tři ireversibilní reakce (na obrázku vyznačeny tučně)
- hexokinázová (glukokinázová) reakce je energeticky posunuta k produktu (je exergonická) a tím pádem prakticky nevratná
- při vzniku
F16BP je také velká změna volné energie, opět hodně exergonická reakce - pyruvát-kinázová reakce, fosfoenolpyruvát je makroergní sloučenina, opět silně exergonická (i když in vitro více než in vivo)
- tyto nevratné reakce se tedy musí obejít
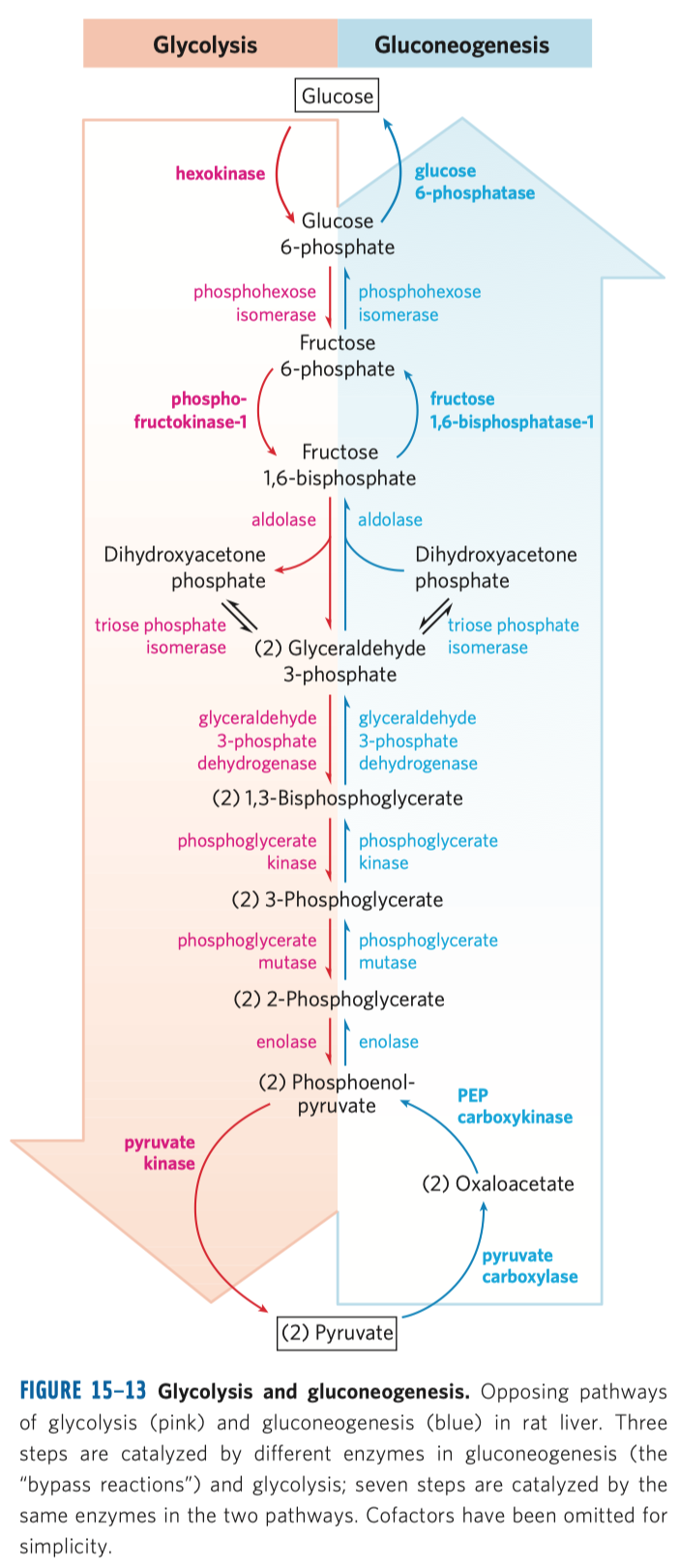
Obcházení pyruvát-kinázové reakce
Viz obrázek—skládá se ze dvou částí.
- pyruvát (tříuhlíkatá sloučenina) je karboxylován na oxaloacetát (čtyřuhlíkatá sloučenina)
- už jsme na ni narazili
- je to anaplerotická reakce, dodává oxalacetát do KC
- může ale sloužit i jako donor substrátu (oxalacetátu) pro
gng
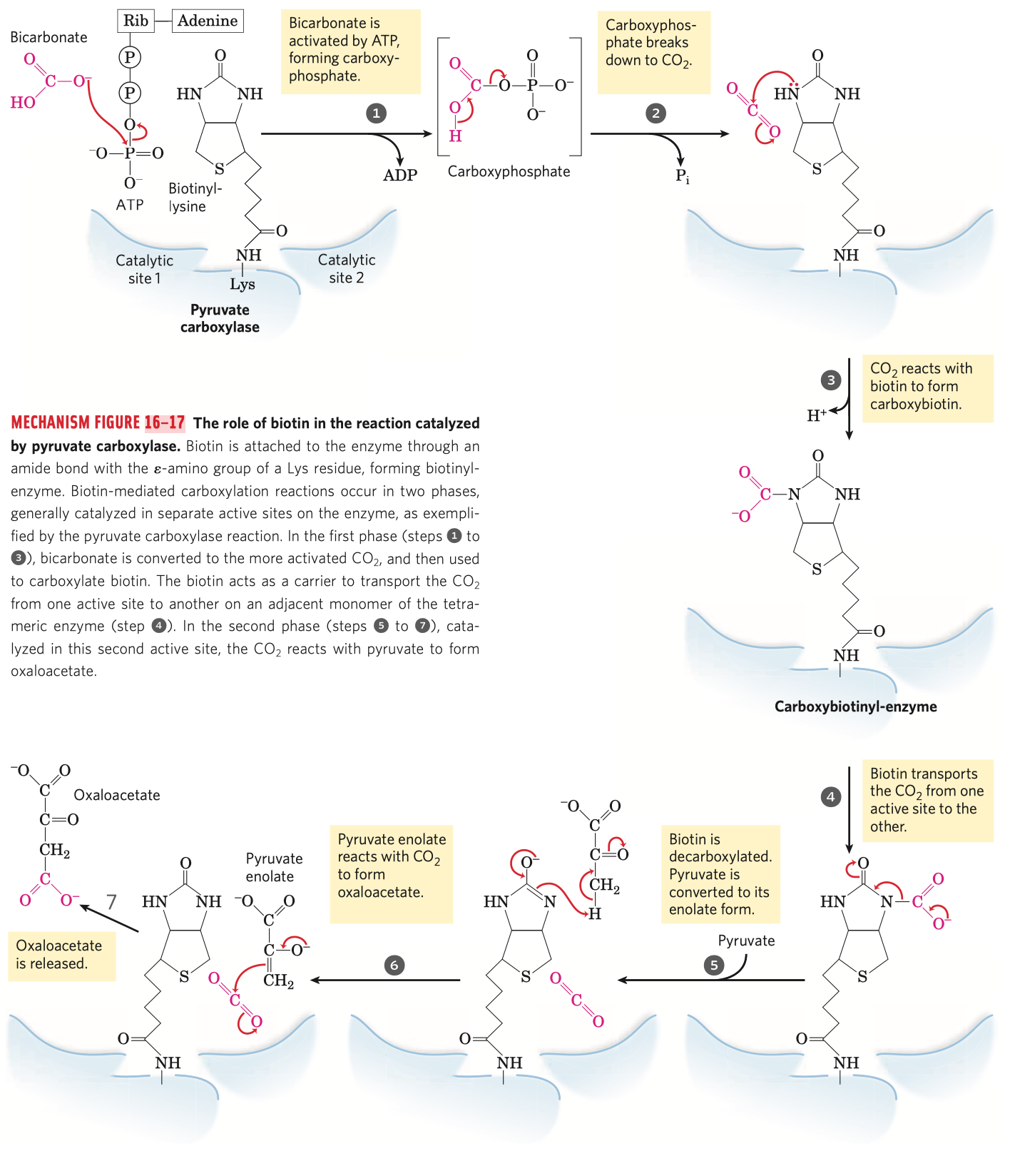
- funguje jako koenzym přenášející karboxylovou skupinu
- mechanismus je podobný, jako jsme už jednou viděli
- biotin se pohybuje na dlouhém raménku Lys
- hýbe se z jednoho reakčního místa, kde naváže karboxylovou skupinu (která tam přichází jako bikarbonát), na druhé aktivní místo enzymu, kde ji předá na pyruvát
- oxaloacetát \(\rightarrow\) fosfoenolpyruvát (PEP)
- PEP je intermediátem glykolýzy, čili opět mohou pokračovat reverzibilní reakce
V pyruvát-kinázové reakci v glykolýze vznikne 1 ATP na jeden fosfoenolpyruvát, ale když reakci obracíme, potřebujeme hned dvě makroergní sloučeniny (pyruvát-karboxyláza potřebuje jednu ATP a fosfoenolpyruvátkarboxykináza zas jednu GTP).
Obcházení zbývajících dvou kinázových reakcí
- obě kinázové reakce jsou nahrazeny fosfatázovými reakcemi
- fruktóza-1,6-bisfosfatáza katalyzuje reakci
F16BP \(\rightarrow\) fruktóza-6-fosfát +\(P_i\) - ireverzibilní kinázová reakce byla obejita hydrolázovou reakcí—fosfát se zde jen hydrolyzuje, nepřidělává se na ADP –na této úrovni organismu se nikdy nemůže syntetizovat ATP, pouze se zde spotřebovává, - to samé platí i pro hexokinázovou reakci, glukóza-6-fosfatázovou reakcí dojde k odštěpení fosfátu a z glukóza-6-fosfátu vznikne glukóza
- je umístěna na membráně ER
- jde o relativně velký komplex, jeho součástí jsou jeden enzym a tři přenašeče
- průběh reakce
- glukóza-6-fosfát je transportována do lumen hladkého ER, kde je aktivní místo enzymu
- enzym odhydrolyzuje fosfát, vznikne glukóza
- tyto produkty jdou z ER přes přenašeče
- glukóza v cytoplazmě je totiž vystavena nebezpečí, že bude transportována z buňky
- to je jedna z věcí, před kterou ji hexokináza fosforylací ochrání
- tím, že je tvořena v ER se tento její osud oddaluje
Kompartmentalizace gng
- první část je v
mch \(\implies\) problém transportu přes vnitřní membránu - začíná se vždy u pyruvátu
- ten se ještě v
mch přemění (pomocí pyruvát-karboxylázy) na oxalacetát - jak dostat oxalacetát z
mch ?- budťo zasáhne
mch PEP karboxykináza, oxalacetát \(\rightarrow\) PEP za spotřeby GTP (PEP má přenašeč) - nebo zasáhne malát-dehydrogenáza, oxalacetát \(\rightarrow\) malát, a poté v cytoplazmě opět malát \(\rightarrow\) oxalacetát
- při tom se však oxiduje jedno
\(\ce{NADH}\) vmch a naopak redukuje se jedno\(\ce{NAD+}\) v cytoplazmě - to může sloužit k transdehydrogenázovým reakcím
- při tom se však oxiduje jedno
- budťo zasáhne
- ten se ještě v
Regulace
- pyruvát má spoustu možností, kam jít
- např. vstoupí do pyruvátdehydrogenázové reakce a vzniká z něj acetyl-CoA, ten jde do KC
- nebo např. může jít do
gng , do pyruvátkarboxylázové reakce (a vznikne z něj oxalacetát)
- čili pokud buňka vyrábí acetyl-CoA z tuků, inhibuje pyruvátdehydrogenázu a aktivuje pyruvátkarboxylázu
- vzniklý oxalacetát může vstoupit jako produkt anaplerotické reakce do KC, nebo půjde do
gng
- vzniklý oxalacetát může vstoupit jako produkt anaplerotické reakce do KC, nebo půjde do
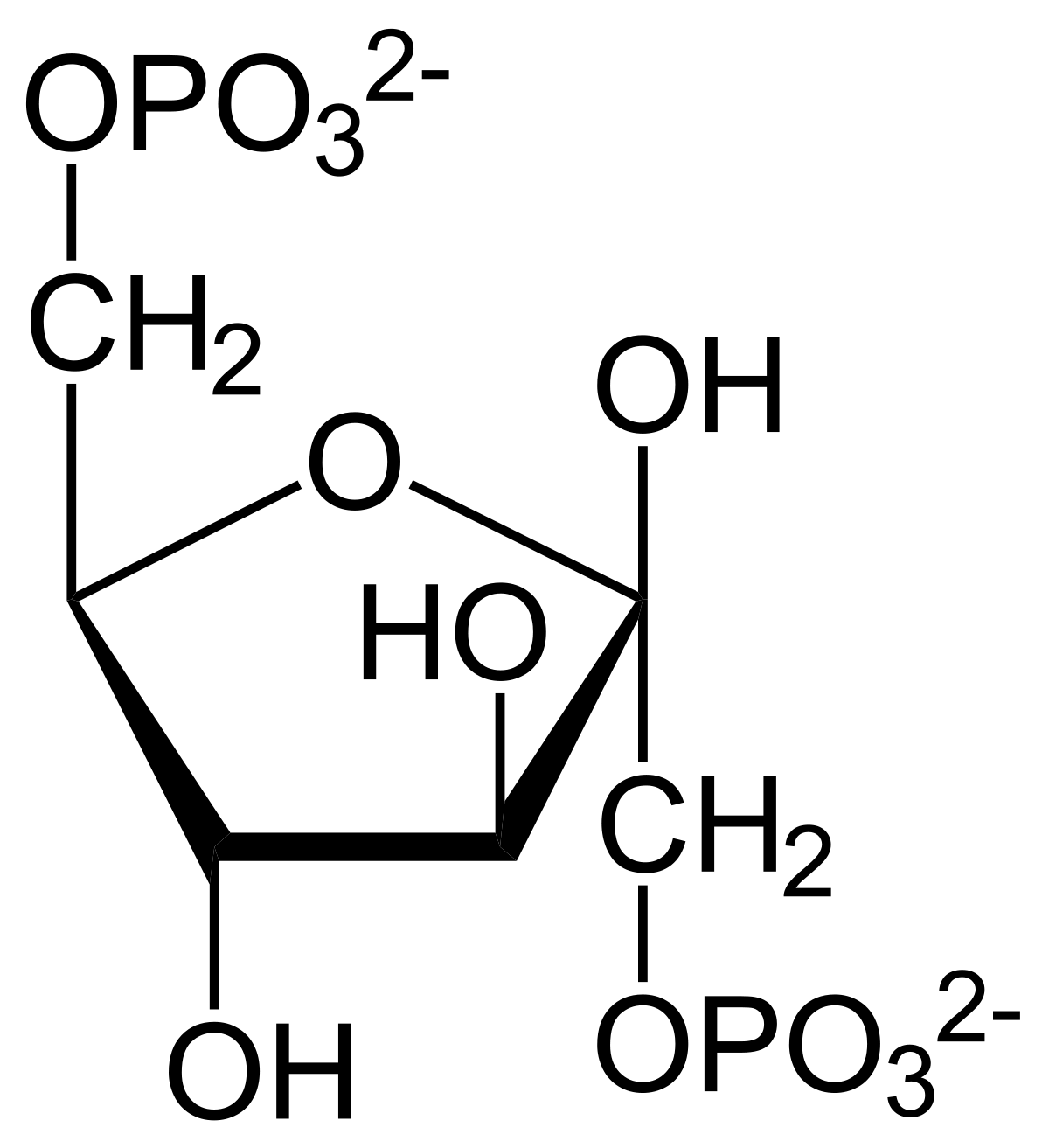
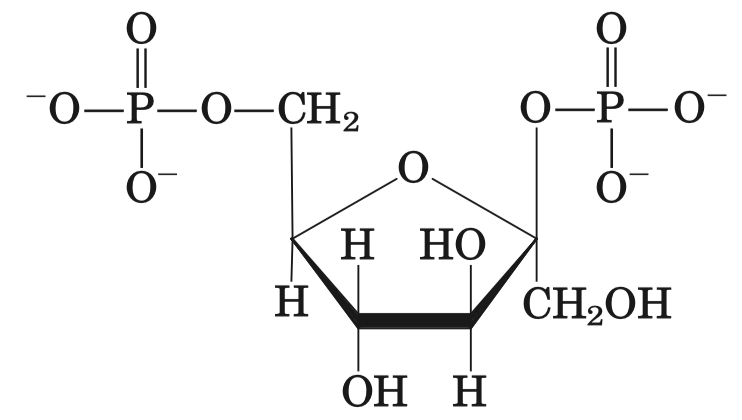
- dále jen F26BP
- je podobná
F16BP , až na polohu fosforu (viz obrázek výše) - regulační molekula, stimuluje fosfofruktokinázu-1 (PFK-1) a inhibuje fruktózu-1,6-bisfosfatázu (FBPáza-1), viz obrázek níže
- tím inhibuje celou
gng a aktivuje glykolýzu
- tím inhibuje celou
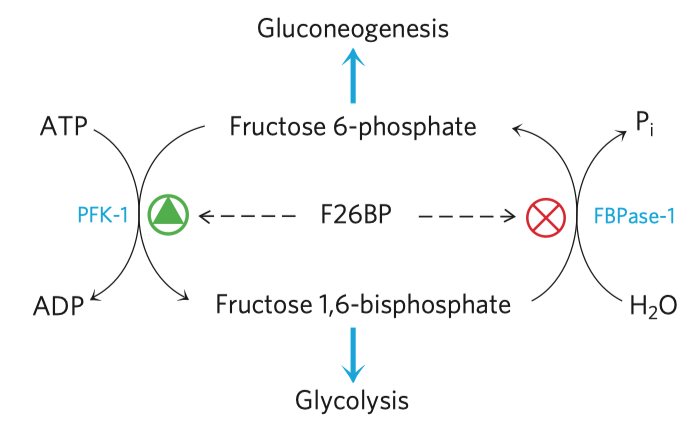
A jak je regulováno množství
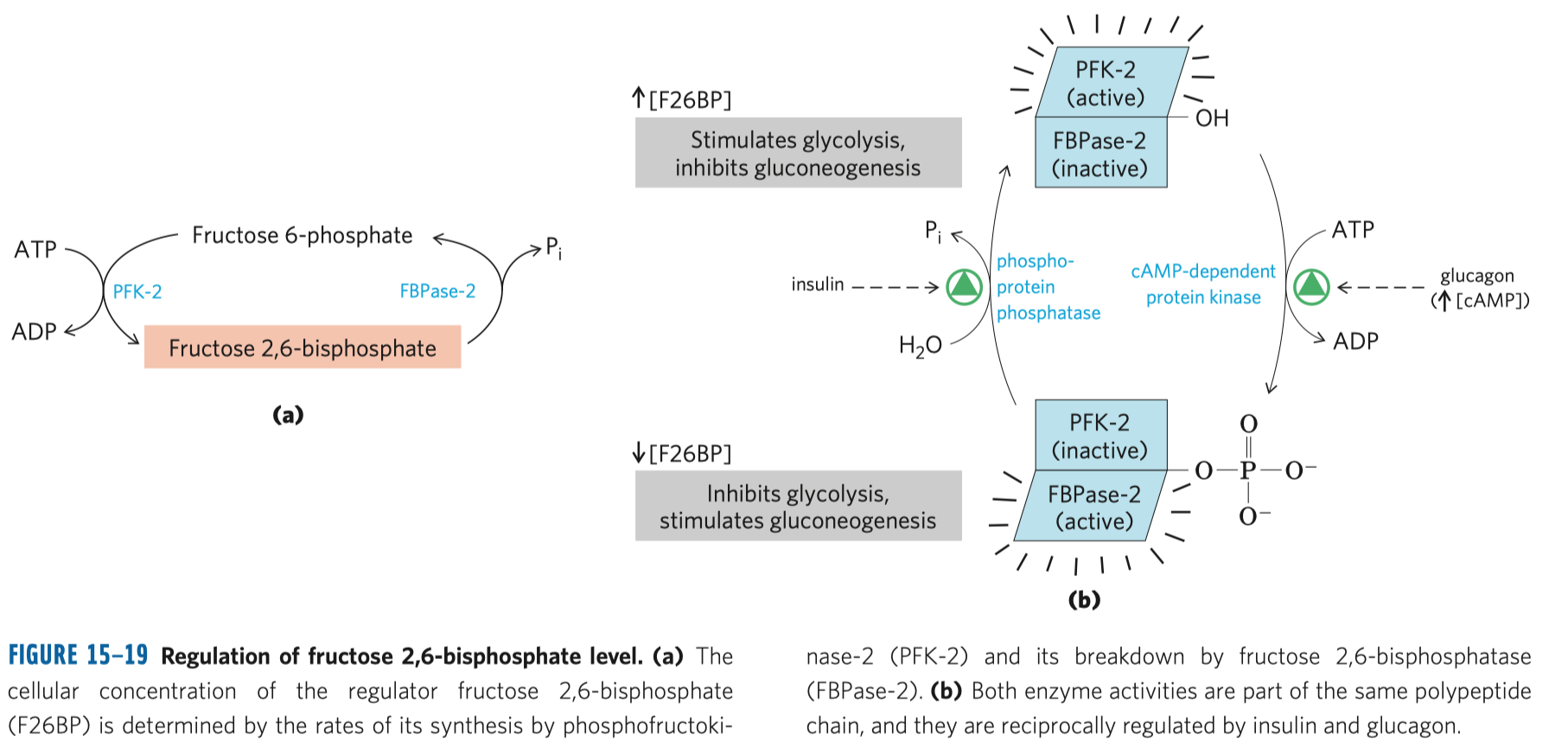
- jsou vlastně jedním proteinem se dvěma doménami
PFK -2 vyrábíF26BP ,FBPáza-2 naopak rozkládá—množstvíF26BP (a tedy relativní aktivace glykolýzy agng ) závisí na poměru aktivityPFK -2 aFBPáza-2 PFK -2 aktivována \(\implies\)F26BP \(\implies\) podpoření glykolýzyFBPáza-2 aktivována \(\implies\) podpořenígng
FBPáza-2 část je nepřímo aktivována glukagonem- glukagon \(\rightarrow\) adenylát cykláza \(\rightarrow\)
cAMP \(\rightarrow\) CDK \(\rightarrow\) fosforylace proteinu - čili: glukagon \(\implies\)
gng
- glukagon \(\rightarrow\) adenylát cykláza \(\rightarrow\)
PFK -2 část je nepřímo aktivována inzulínem- inzulín \(\rightarrow\) fosfoprotein fosfatáza \(\rightarrow\) defosforylace proteinu
- čili: inzulín \(\implies\) glykolýza
Shrnutí:
Pentózofosfátová dráha
- rozklad glukózy-6-fosfátu (glukóza zpracovaná hexokinázou), avšak ne na triózy, ale na pentózy
- neobyčejně důležité–vzniká ribóza (součást NK, ATP, koenzymu NADH, NADPH atd.)
- je amfipatická
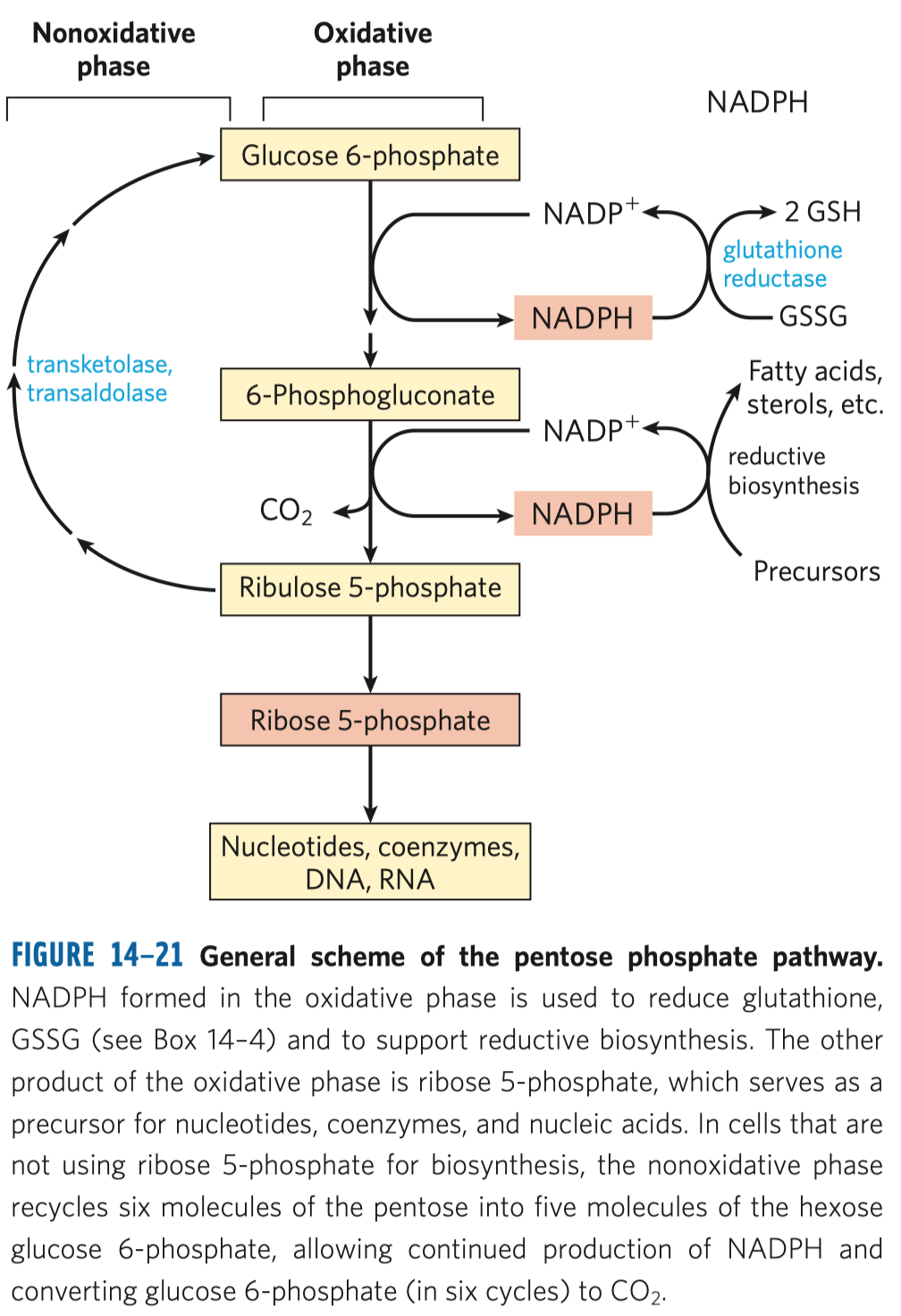
- ne vždy ribózu potřebujeme, dráha se někdy využívá pouze ke generování NADPH
- např. při laktaci potřebujeme hodně MK (hodně NADPH), ale ribózy nějak moc ne
- opačným příkladem by byla např. regenerace jater, při které místo MK potřebujeme hlavně NK (tedy hodně ribózy)
- glukózu je možné regenerovat (tedy pentózu vrátit zpět na hexózu), poté spustit celou oxidativní část znovu, získat opět dvě NADPH a tak dokola
- tato proměna (5\(\rightarrow\)6) probíhá v neoxidativní části dráhy
- pentóza se mění na hexózu pomocí transketolázových a trans-aldolázových reakcí
Průběh oxidativní části
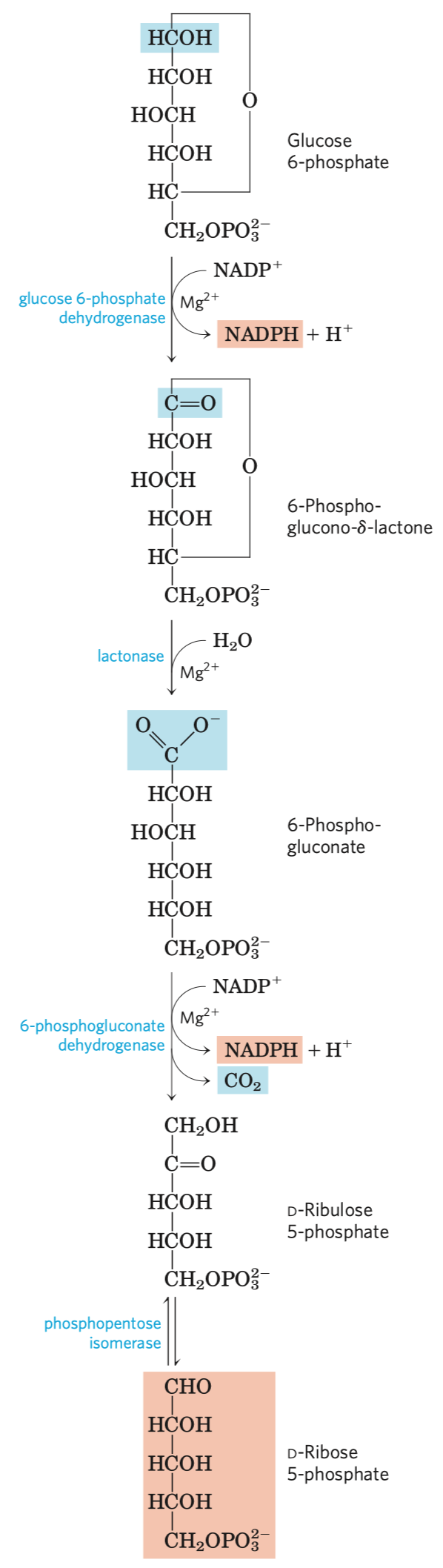
Reakce jsou zřetelné z obrázku, následují pouze drobné poznámky.
- dekarboxylací se odrhne jeden uhlík, zbyde nám pentóza
Celkově vzniknou dvě molekuly NADPH a jedna molekula ribózy.
Průběh neoxidativní části
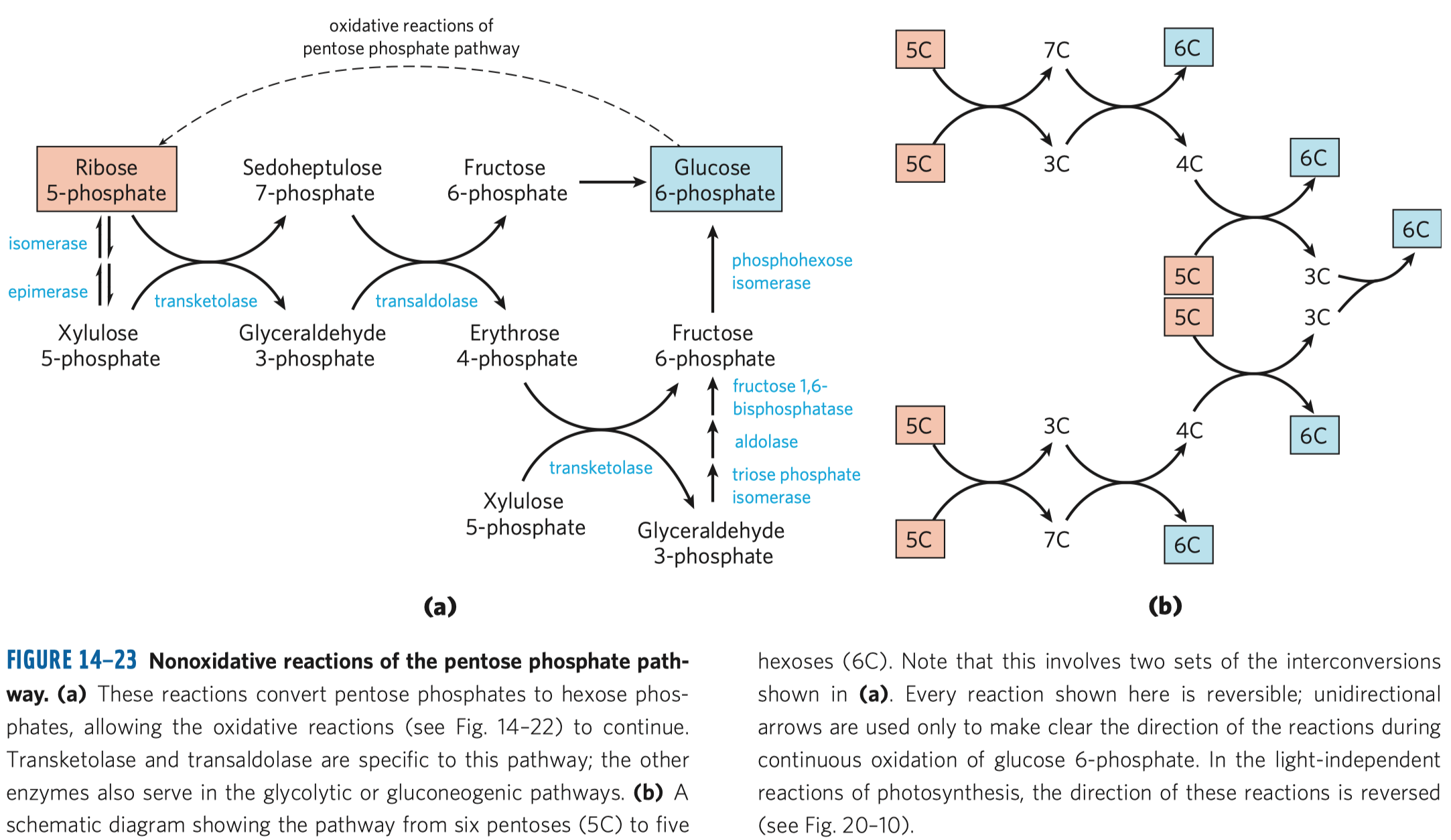
- probíhá v nich přehazování uhlíků, v konečném důsledku převádějí pentózy zpět na hexózy
- na začátku vstupuje ribóza-5-fosfát a xylulóza-5-fosfát, která vznikne izomerací z ribózy-5-fosfátu
- viz obrázek
Lipidy, mastné kyseliny a jejich metabolismus
- Lipidy
- Různorodá skupina látek, které spojuje to, že jsou rozpustné v nepolárních rozpouštědlech. Nejběžnějším příkladem jsou triacylglyceroly.
- Triacyglyceroly
- Estery glycerolu—na glycerolu (trojsytném alkoholu) jsou esterovou (hydroxylová+karboxylová) vazbou napojeny tři mastné kyseliny (viz obrázek níže).
- Glycerofosfolipidy
- Hlavní složky membrán, ampfipatické molekuly, mají dva ocásky z MK a na třetím je navázáno něco polárního, např. fosfatydilcholin, alkohol atp. Jsou prekurzory druhých poslů (jako např.
cAMP ) a slouží k ukotvení proteinů v membráně pomocí tzv. GPI kotvy. - Vosky
- Estery MK a alkoholů s dlouhým řetězcem, např. včelí vosk, vorvaňový vosk a lanolin.
- Terpeny
Molekuly z izoprenových podjednotek, řadí se mezi izoprenoidy.
Izopren je 2-methyl-1,3-butadien, tvoří aromatické látky, a vyskytuje se hlavně v rostlinných hormonech. Blue Ridge Mountains ve Virgínii dostaly své jméno podle modrého oparu způsobeného právě izoprenem, který rostliny přes léto uvolňují.
Mastné kyseliny
- mají dlouhý řetězec, 4 a více uhlíků
- pojmenování
- často jsou pojmenované triviálně, podle toho, z čeho byly izolovány
- označují se i čísly,
[# uhlíků]:[# dvojných vazeb]:[umístění dvojných vazeb]?- stearová je 18:0 (18 uhlíků, žádná dvojná vazba)
- olejová je 18:1:9 (18 uhlíků, dvojná vazba na devátém z nich)
Velice důležitá (dokonce esenciální) je pro nás kyselina arachnidová (20:4:5,8,11,14)—je prekurzorem pro syntézu hormonů prostacyklinu, tromboxynu atd.
- Nasycené MK
- Nemají dvojnou vazbu. Opakem jsou nenasycené MK.
- Polynenasycené
- Mají více násobných vazeb.
O to, které jsou zdravé a nezdravé, se stále vedou spory—v současnosti se prosazují ty s mnoha nenasycenými vazbami, jako např. kukuřičný olej a olej světlice barvířské.
Oxidace MK
- oproti sacharidům a polysacharidům skladnější, v přepočtu uložené energie na hmotnost jsou výhodnější
- např. ptáci by pouze s cukrovými zásobami dlouhé migrace nezvládli (buďto by měli málo energie, nebo by se neunesli)
- i člověk má tuk jako zásobní substrát
- ale trvá dlouho, než se energie zmobilizuje
- zvířata závislá na tuku: zpravidla s omezeným přístupem k pitné vodě, jsou tedy závislé na metabolické vodě, ta vzniká na komplexu 4
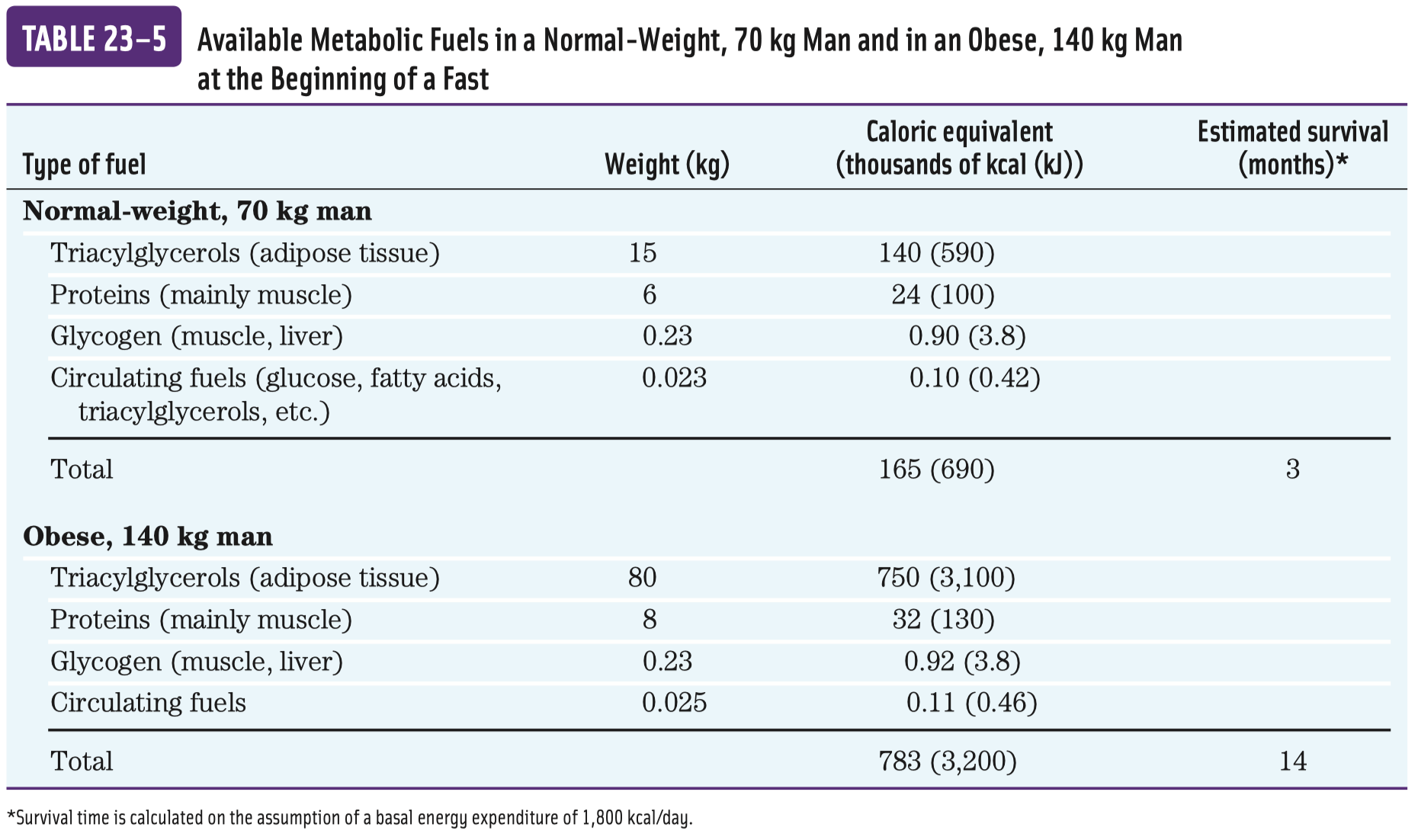
- sprinteři: ATP ve svalech \(\rightarrow\) kreatinfosfát \(\rightarrow\) anaerobní glykolýza
- mílaři: aerobní glykolýza (glykogen \(\rightarrow\)
\(\ce{CO2}\) ) \(\rightarrow\) nastupuje tuková tkáň - maratonci: oxidace mastných kyselin
- rozložení tuků na MK a transport MK do buněk
- rozložení MK v buňce
- aktivace MK
- transport MK do
mch - β-oxidace, rozložení MK
- KC, OF
Rozložení tuků na MK
- tuky v trávicí soustavě tvoří kapénky, jež jsou špatně napadnutelné enzymy
- \(\impliedby\) tuky josu velice hydrofobní
- je nutné je emulgovat
- žlučové kyseliny a jejich soli tuky emulgují, tvoří se micely
- lipázy ve střevě odštěpují jednotlivé MK
- MK se dostávají přes membránu, stávají se z nich chylomikrony
- chylomikron je útvar tvořený jednovrstevnou membránou s triacylglyceroly a estery uvnitř
- chylomikrony jdou přes stěnu střevní sliznice do krve
- v krvi se rozpadnou na MK a jsou transportovány na místo určení
- pokud jsou potřeba hned tak do myocytů (svalů)
- pokud hned potřeba nejsou, jdou do bílé tukové tkáně, kde se z nich znovu tvoří glyceroly a tukové kapénky
- v krvi jsou MK vázány na sérový protein albumin
Aktivace MK
MK se musí dostat do
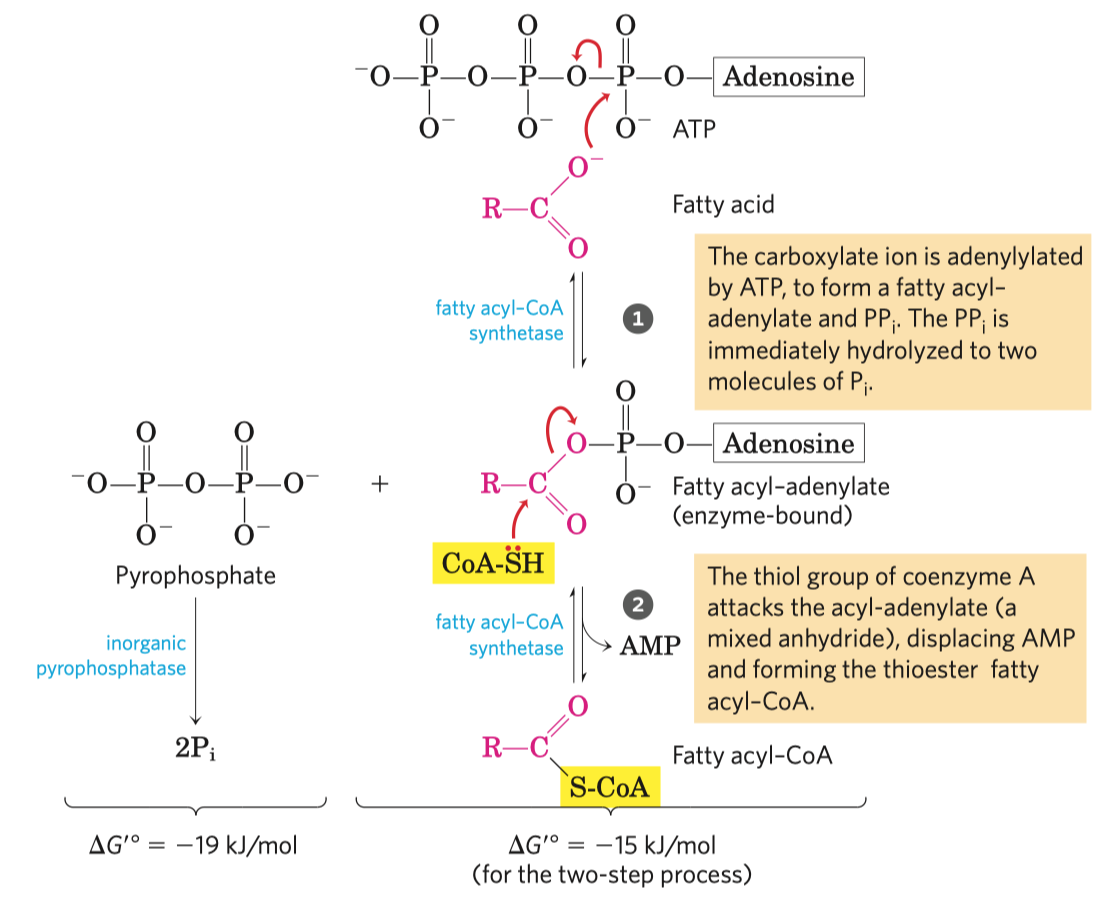
Celková přeměna je tedy
a je silně exergonická (
Transport MK do mch
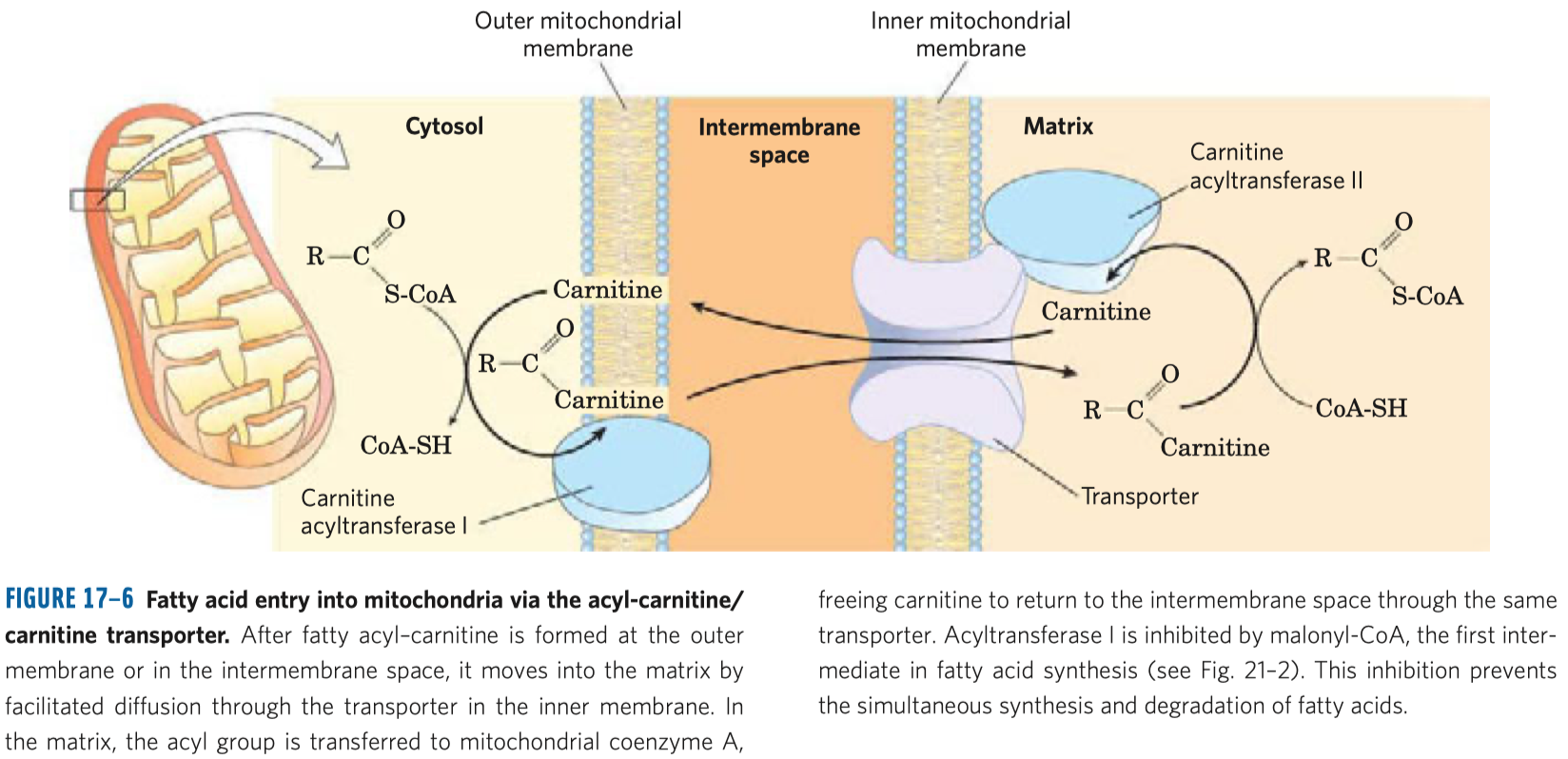
- k tomu slouží molekula karnitin, součást acyl-CoA-karnitinového cyklu
- karnitin je mnohem menší, než CoA, proto se lépe dostává přes membránu; zásobárny CoA v cytoplazmě a
mch jsou oddělené
- karnitin je mnohem menší, než CoA, proto se lépe dostává přes membránu; zásobárny CoA v cytoplazmě a
- v cyklu též figurují enzymy kartininacyltransferázy I (vnější membrána) a II (vnitřní membrána)
- kartininacyltransferázy reálně tvoří komplex procházející přes obě membrány
- viz obrázek
Beta-oxidace
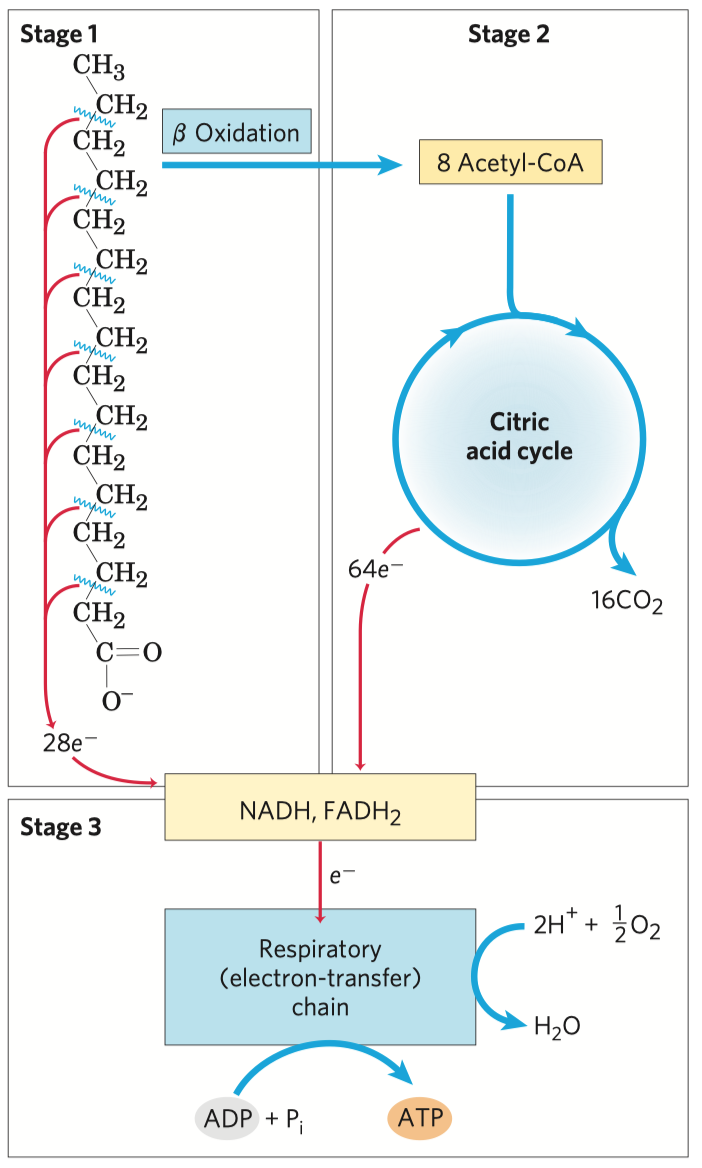
- ve výsledku rozštípá MK na dvojuhlíkaté zbytky, které poté jako acetyl-CoA vstupují do KC a kromě toho také uvolní elektrony v podobně redukovaných koenzymů, které se poté účastní OF
- skládá se ze čtyř reakcí
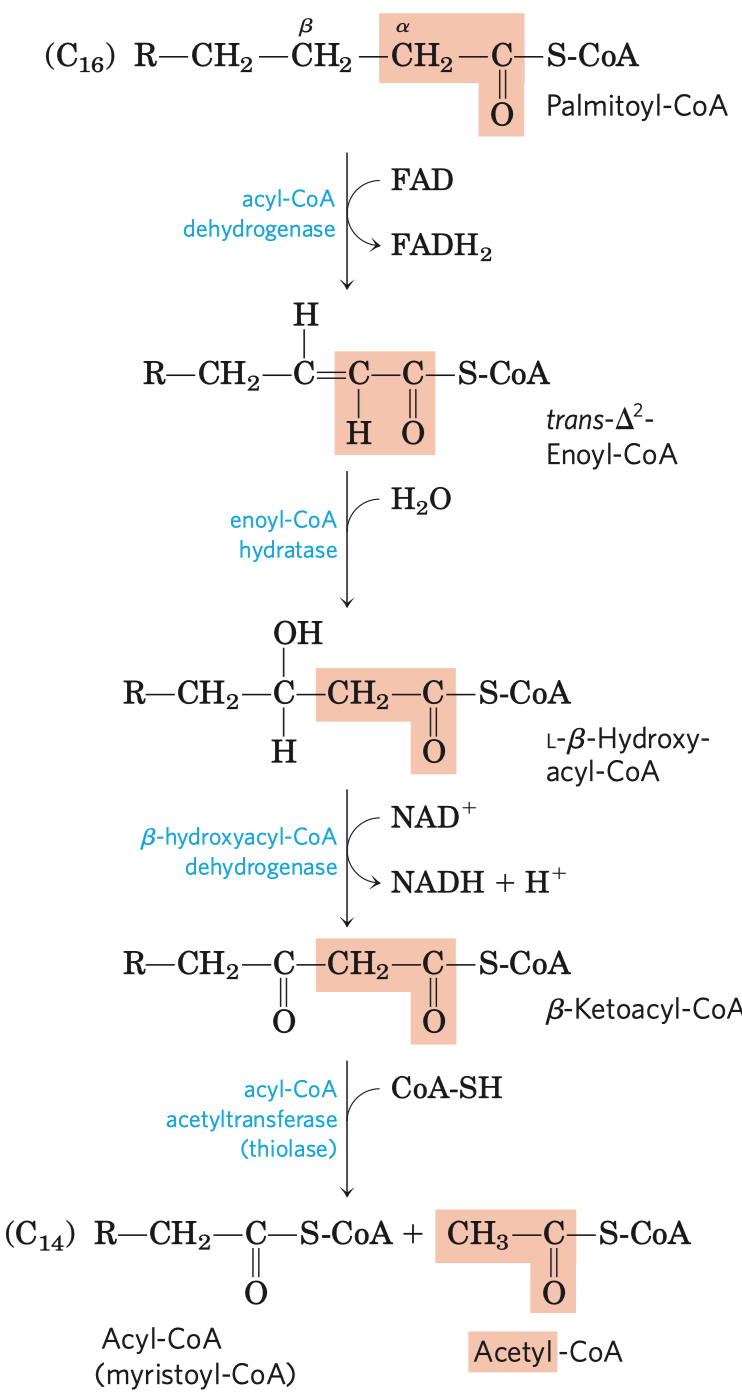
Viz obrázek, popisky jen doplňují detaily.
- acyl-CoA dehydrogenáza oxiduje MK
- jako koenzym má FAD, který se redukuje a postupuje do OF
- v enoyl-CoA je dvojná vazba mezi α a β uhlíky, které se chceme zbavit
- α uhlík proto hydratujeme
- na β uhlíku vytvoříme karbonylovou skupinu
- u toho se redukuje
\(\ce{NAD+}\)
- zbyde nám MK-acyl-CoA, přičemž MK je nyní o dva uhlíky kratší
β-oxidaci se někdy říká též Lynenova spirála
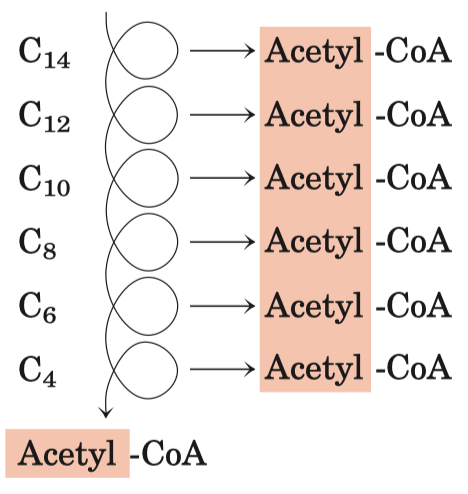
- na konci β-oxidace vznikne propionyl-CoA
- ten je potřeba přemenit tak, aby mohl vstoupit do KC
- přemění se na sukcinyl-CoA
- k procesu je potřeba vitamín
\(\ce{B12}\) - celou reakci není potřeba umět
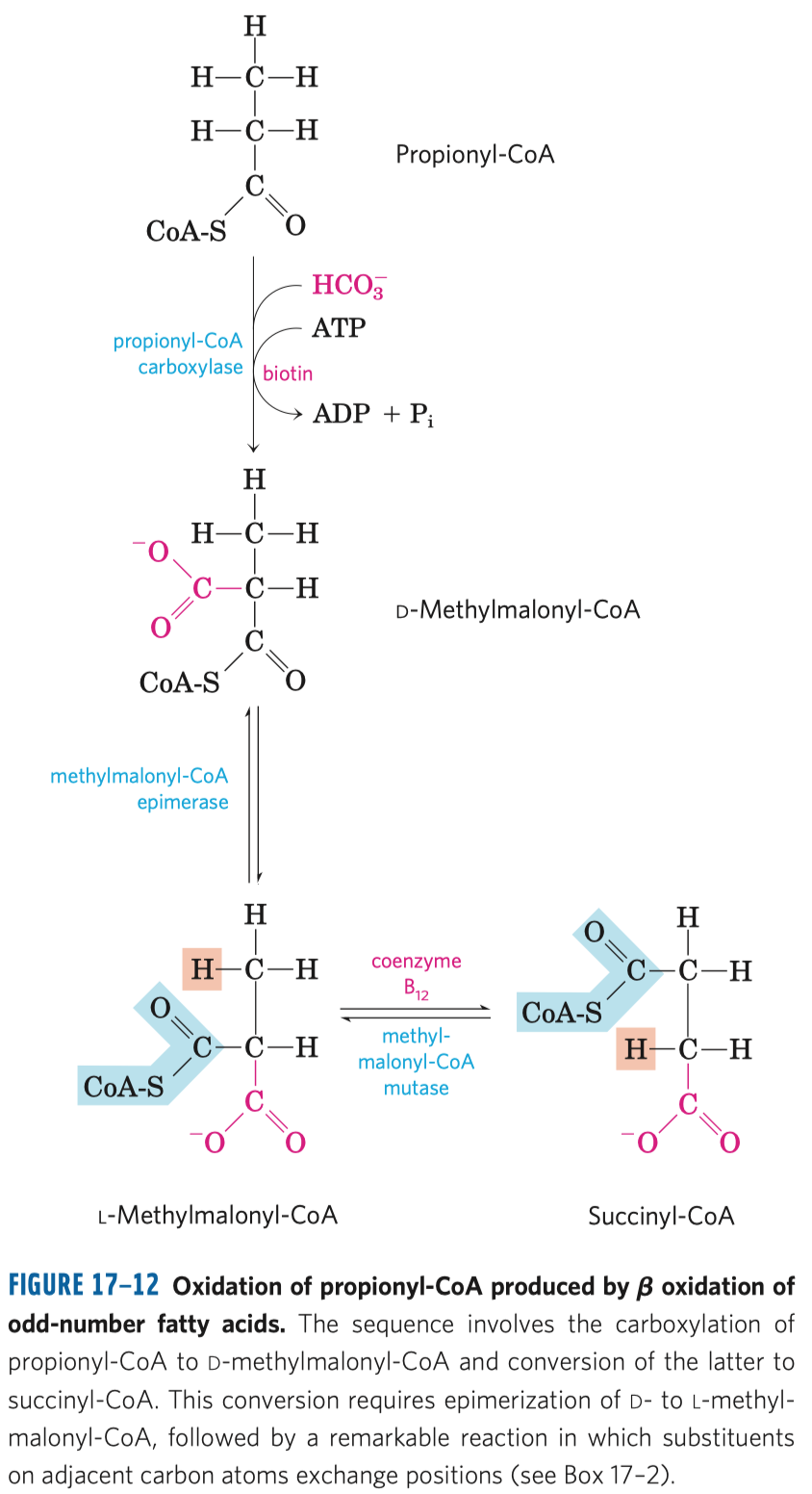
- dvojné vazby je potřeba nahradit jednoduchými
- pak se normálně odbourávají (někdy probíhá například ω-oxidace)
- celou reakci není potřeba umět
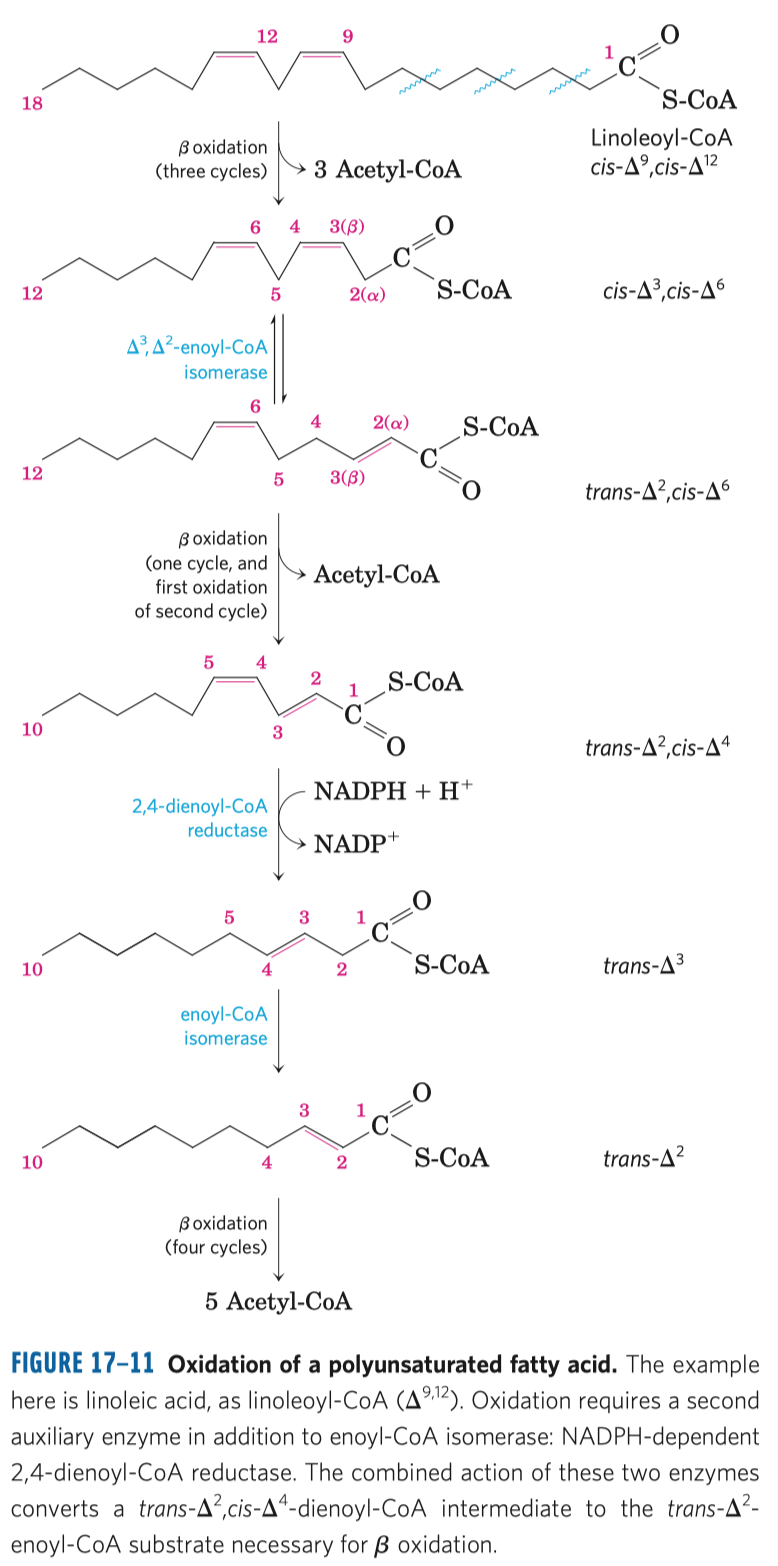
Zisk ATP
V následující tabulce můžeme vidět zisk z β oxidace jedné molekuly palmitoyl-CoA. Kdybychom počítali zisk z palmitátu, musíme ještě odečíst 2 ATP za jeho aktivaci na palmitoyl-CoA.

Lokalizace
- kromě
mch probíhá i v peroxisomech, u rostlin dokonce výhradně tam- dráhy jsou vlastně principiálně shodné
- liší se tím, že v peroxisomech se oxidují MK s dlouhými řetězci (>20) na osmi-uhlíkaté zbytky a ty poté pokračují do
mch - navíc v prvním kroku v mitochonrdii vzniká o jeden redukovaný koenzym více
- liší se tím, že v peroxisomech se oxidují MK s dlouhými řetězci (>20) na osmi-uhlíkaté zbytky a ty poté pokračují do
- dráhy jsou vlastně principiálně shodné
- enzymy pracují buďto jako samostatné entity, nebo v superkomplexech
- peroxisomální a glyoxysomální komplexy mají různé počty vazebných míst pro MK různé délky
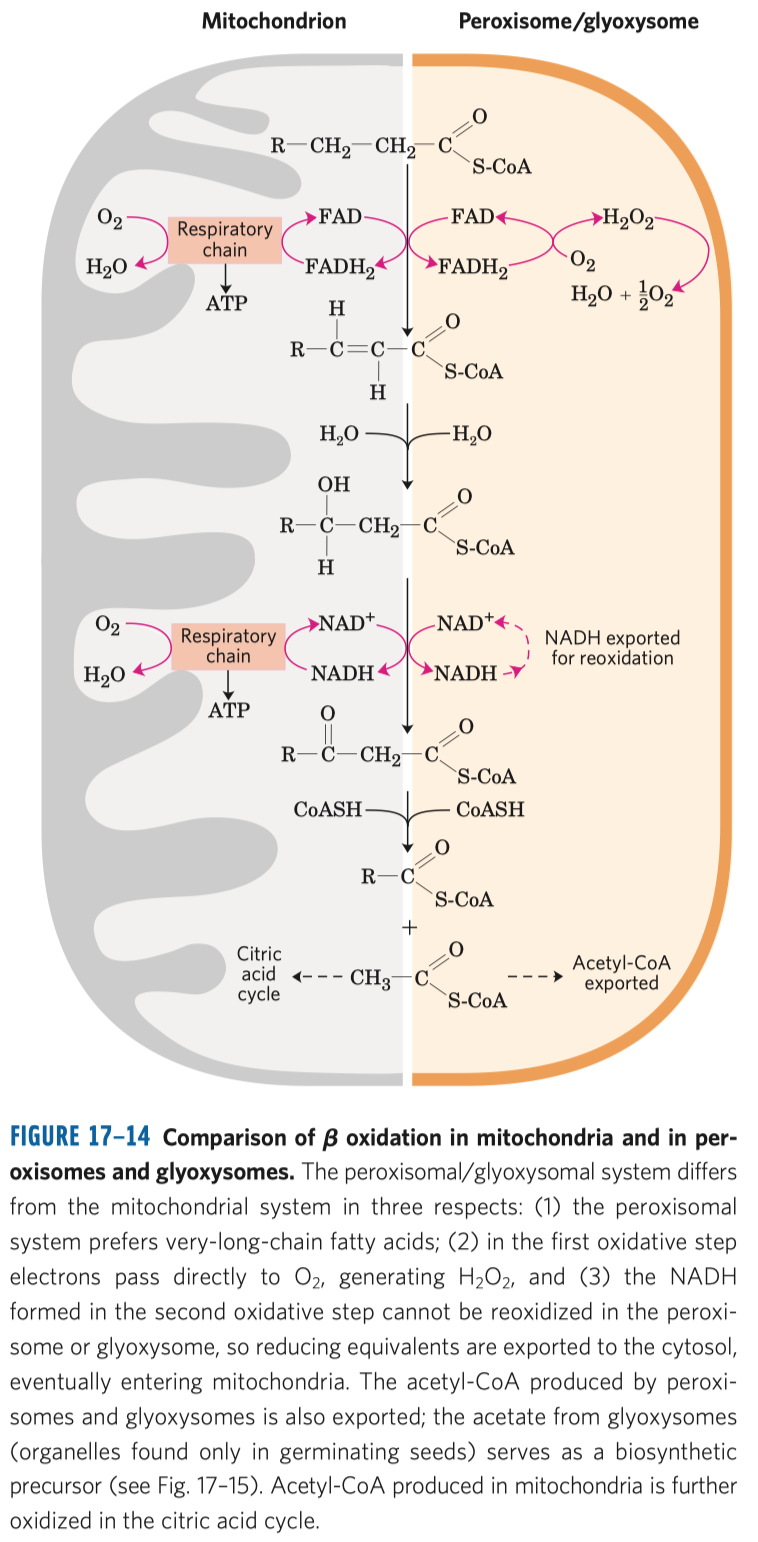
Ketolátky
- aceton, acetoacetát, hydroxybutyrát
- běžný postup: MK \(\rightarrow\) acetyl-CoA \(\rightarrow\) KC
- pokud je málo oxalacetátu, KC se zastaví
- oxalacetát se běžně doplňuje anaplerotickými reakcemi, ale pro ty jsou výchozím substrátem produkty glykolýzy
- KC se tedy při nedostatku cukru (např. u neléčených diabetiků, za okolností vyčerpání) zastaví
- za takových okolností vznikají ze dvou acetyl-CoA právě ketolátky
- lidem jde poté z úst cítit aceton
- přestupují hematoencefalickou bariéru \(\implies\) mohou sloužit v mozku (a dalších tkáních) jako zdroj energie
Metabolismus tuků
- když pro nějakou sloučeninu existuje katabolická i anabolická dráha, musí být odlišné
- je to termodynamicky nutné a navíc to ulehčí nezávislou a jemnější regulaci
- proto se syntéza MK a β-oxidace musí lišit
- redoxnost
- β-oxidace je oxidativní proces
- syntéza MK je reduktivní proces
- lokalizace
- β-oxidace běží v
mch - syntéza MK běží v reduktivním prostředí v cytoplazmě
- β-oxidace běží v
- přenašeče acylu
- u β-oxidace je jím CoA
- u syntézy MK je jím speciální protein acyl carrier protein (dále jen ACP)
- přenašeče elektronů
- β-oxidace je oxidativní \(\implies\) potřebuje akceptor, je jím FAD
- syntéza MK je reduktivní \(\implies\) potřebuje donor, je jím
\(\ce{NADPH + H+}\)
- přenášení dvojuhlíkatých jednotek
- u β-oxidace se o to staral acetyl-CoA
- u syntézy MK jsou přidávány pomocí malonylu-CoA
Přestože je přenašečem acylu ACP, skupina, na kterou je acyl připojen, je stále stejná: fosfopanteteinová skupina.
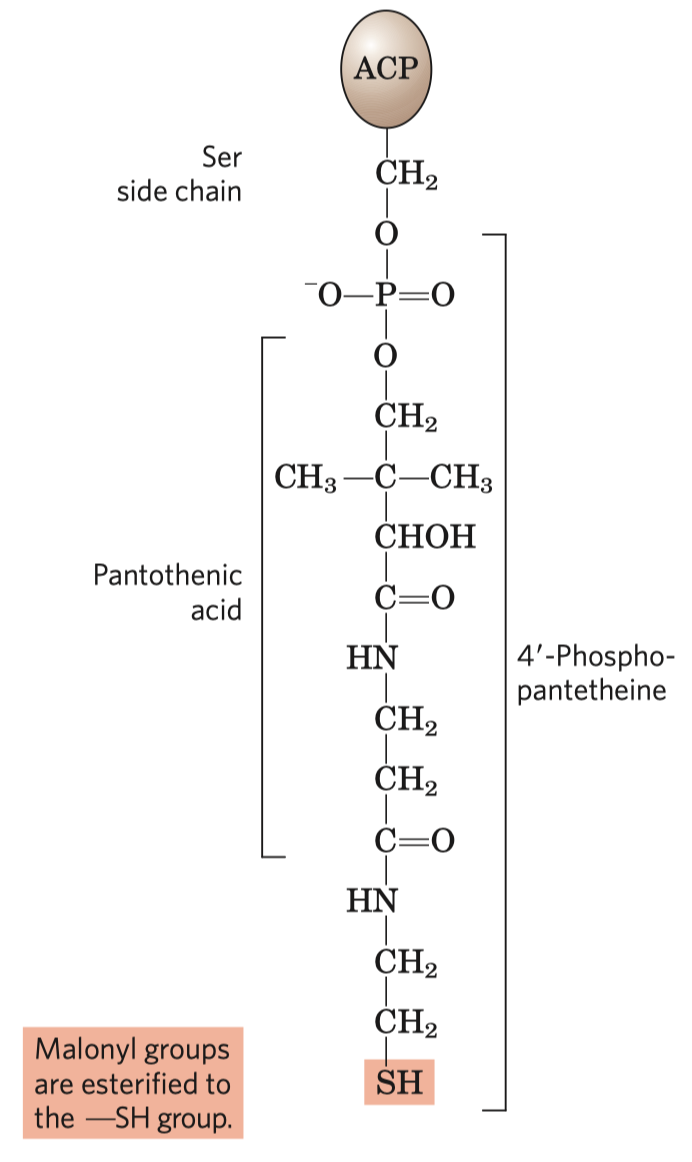
Příprava malonylu-CoA
O přeměnu z acetyl-CoA na malonyl-CoA se stará enzym acetyl-CoA-karboxyláza (dále jen ack).
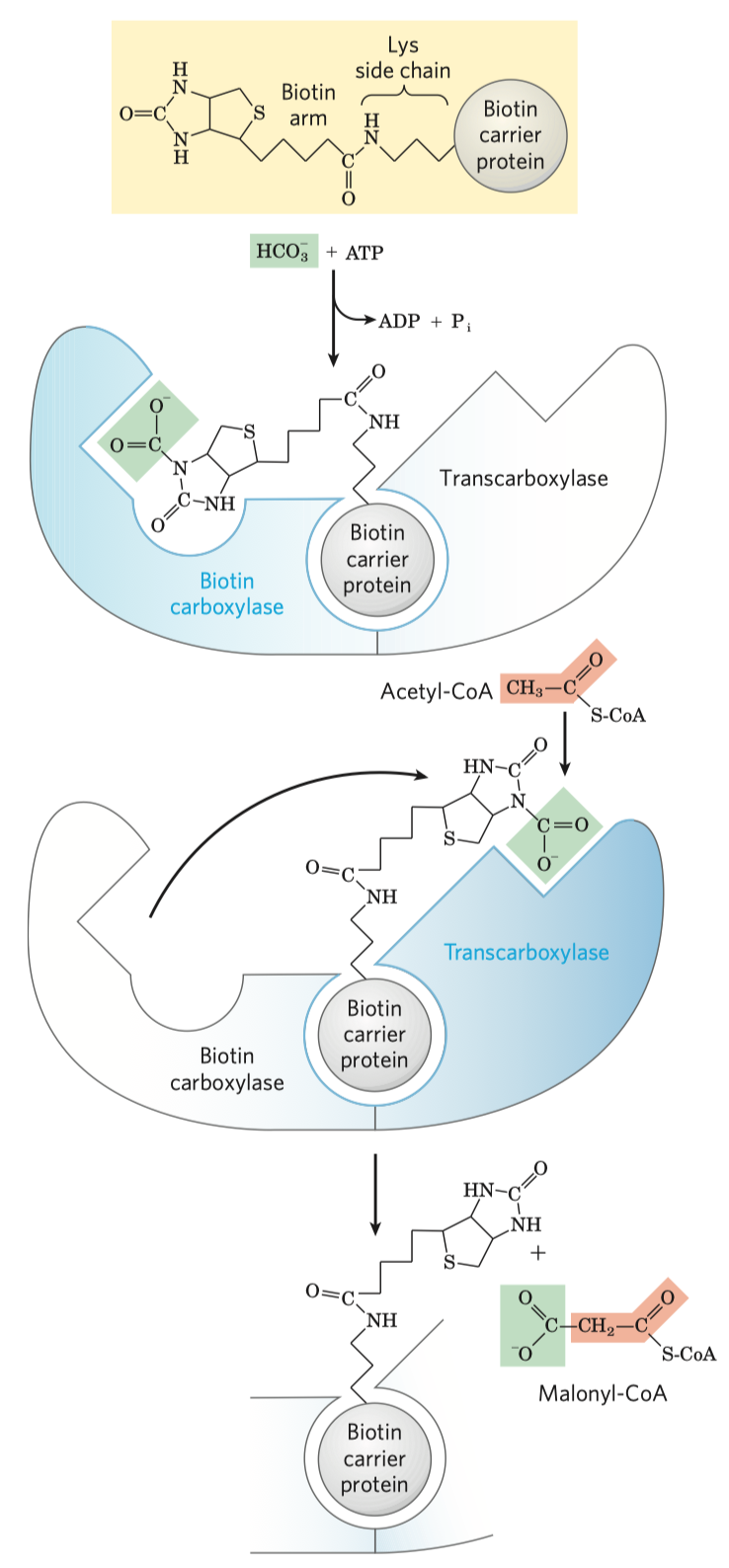
- potřebuje dodání energie v podobě ATP (katalyzuje endergonický proces)
- kofaktorem je biotin (vitamín A)
- umí vázat karboxyl a pomocí pohyblivého raménka jej přenést jinam
- má dvě enzymatické aktivity
- biotin-karboxylázová aktivita (vazba
\(\ce{COO-}\) na biotin) - trans-karboxylázová aktivita (vazba
\(\ce{COO-}\) z biotinu na acetyl-CoA)
- biotin-karboxylázová aktivita (vazba
- kromě svých dvou funkcí ještě plní funkci přenašeče biotinu
Regulace ack
- hlavní regulační enzym syntézy MK
- regulace fosforylací a alostericky, působením lokálních metabolitů
- v nativní konformaci je ve formě polymeru vytvářejícím dlouhé filamenty
- při deatkivaci se polymer rozpadá na jednotlivé protomery
Regulace fosforylací
ack je inhibována fosforylací (tedy kinázami) a aktivována fosfatázami
- funguje jako senzor nízké hladiny energie v buňce
- koncentrace AMP je vysoká \(\iff\) koncentrace ATP je nízká
- když je aktivní, inhibuje
ack , protože v době nízké hladiny energie nechceme provádět složitou syntézu MK
- je aktivována v odpovědi na hormonální reakci glukagonu a adrenalinu
- funguje něpřímo jako senzor nízké hladiny cukru v krvi
- když je aktivní, inhibuje
ack , protože chceme využít acetyl-CoA na syntézu ketolátek (energetických náhražek glukózy)
- inzulín aktivuje
PKA , kteráack defosforyluje a tím aktivuje
Regulace lokálními metabolity
- zpětnovazební inhibice produktem, palmitoyl-CoA (nejběžnější produkt syntézy MK)
- aktivace citrátem
- hodně citrátu \(\implies\) nejspíše i hodně acetyl-CoA \(\implies\) využijeme ho k syntéze MK
Syntéza MK
- u obratlovců běží na jednom z největších multienzymových komplexů v buňce, syntáze MK (dále jen FAS, fatty-acid-synthase)
- dimer, každý monomer má sedm různých katalytických aktivit + přenašeč acylu
- donorem prvních dvou uhlíků je acetyl-CoA, všechny ostatní uhlíky jsou z malonylu
- nejdelší mastná kyselina, která se takto syntetizuje, je palmitát (C16)
- je velmi energeticky náročná
- v sedmi kolech prodlužování nutných k výrobě C16 je investováno 7 ATP a 14 NADPH
Viz obrázek, následují pouze drobné poznámky.
- přenos acylu: acetyl-CoA \(\rightarrow\)
ACP - katalyzována acetyl-CoA-ACP-transacylázou (na obrázku MAT)
- přenos acylu:
ACP \(\rightarrow\) kondenzační enzym (na obrázku KS)
Předchozí dvě reakce probíhají pouze v prvním cyklu, v druhém by byly nahrazeny přenesením malonylu z CoA na
- acetyl + malonyl \(\rightarrow\) acetoacetyl-ACP (někdy také β-ketobutyryl-ACP)
- kondenzační reakce
- acetoacetyl je ketolátka, v dalších reakcích bude potřeba ji přeměnit na lineární řetězec budoucí MK (butyryl)
V β-oxidaci jsou dvě oxidace, tedy v rámci syntézy MK budou dvě redukce.
- první z redukčních reakcí (redukuje se keto skupina na β uhlíku)
- acetoacetyl-ACP \(\rightarrow\) D-β-hydroxybutyryl-ACP
- dehydratace (v β-oxidaci je naopak hydratace)
- už tam není ani alkoholová skupina, zbyla jen ketoskupina
- druhá z redukční reakcí
- redukuje se hydrogenací, ruší se dvojná vazba
- vzniká butyryl-ACP
Butyryl má pouze 4 uhlíky, palmitát je C16, proto musí výše zmíněná reakce proběhnout ještě šestkrát (pokaždé se přidají dva uhlíky). Výsledným produktem (po celkem sedmi cyklech) je palmitoyl-ACP.
- z palmitoyl-ACP je nutné odštěpit
ACP - to dělá palmitoyl-thioesteráza
- celá reakce je díky
FAS velice efektivní- fosfopanteteinové rameno přenáší acylový zbytek mezi jednotlivými reakcemi, takže se jednotlivé reaktatnty nemusí tolik hledat
FAS je dimer a obě podjednotky spolu spolupracují, vyrábějí dvě MK najednou- kooperuje jeden
ACP z jedné podjednotky a kondenzační enzym z druhé podjednotky
- kooperuje jeden
- v bakteriích a chloroplastech nejsou podjednotky v dimerech, ale volně v cytoplasmě
Přenos důležitých reaktantů na místo reakce
- vyrábí se v
mch , je nutné jej nějak dostat přes membránu- trikarboxylový transportní systém
- výměnou do
mch je nesen malát nebo pyruvát
- zdroje: pentózo-fosfátový cyklus a přeměna malátu na pyruvát
Elongace a desaturace MK
Buňka někdy potřebuje delší MK než je palmitát, nebo nenasycené MK.
- běží hlavně v ER, ale zčásti i v
mch - v ER je zdrojem dvouhlíkatých podjednotek pro prodlužování také malonyl
- v
mch je to acetyl-CoA - v ER je reakce závislá na syntéze MK, jednotlivé enzymatické aktivity jsou odděleny na různých enzymech
- v
mch elongace na syntéze závislá není a probíhá spíš jako obrácená β-oxidace
- přenašečem acylů je na rozdíl od syntézy MK CoA, nikoli
ACP
- hrozí nebezpečí, že by při tvorbě dvojných vazeb mohly vznikat nebezpečné peroxidy
- vázané na membránu ER, spojeno s elektrotransportním řetězcem, který zabrání vzniku peroxidu
- provádí ji desaturázy
- savčí desaturázy neumí desaturovat dále než na Δ9, tj. maximálně 9 uhlíků od karboxylové skupiny
- všechny MK, které jsou desaturované dále než na devátém uhlíku musíme přijímat v potravě, jsou tzv. esenciální
- linoelová, linolenová
Elongace a desaturace jsou často kombinované, napč. při tvorbě arachidonátu.
Syntéza triacylglycerolů
- poté, co máme nasyntetizovány MK a máme k dispozici glycerol, může začít syntéza živočiných tuků—triacylglycerolů
- glycerol je esterifikován třemi zbytky MK
- vychází z dihydroxyacetonfosfátu a z glycerolfosfátu
- dihydroxyacetonfosfát vzniká v glykolýze, ve čtvrté (aldolázové) reakci
- při hladovění může docházet ke glycerogenezi
- zkrácená dráha
gng z oxaloacetátu, která končí dihydroxyacetonfosfátem a jeho redukcí na glycerolfosfát
- zkrácená dráha
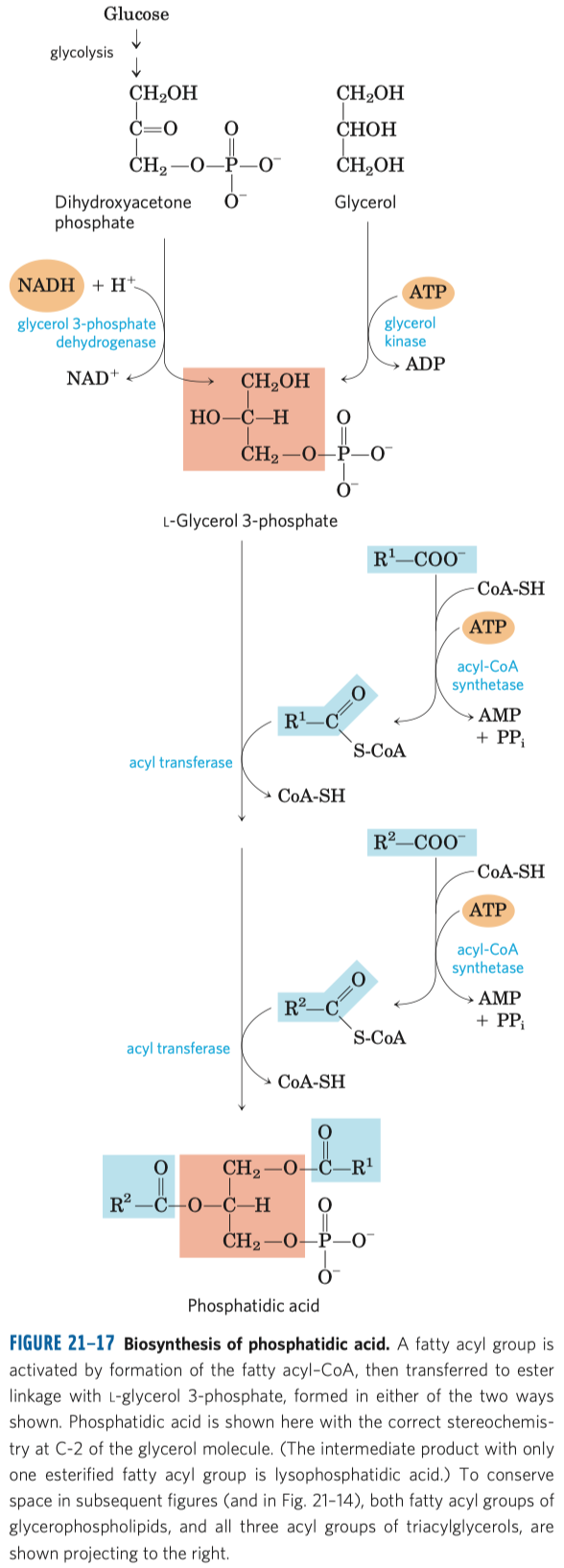
- kyselina lyzofosfatidová a kyselina fosfatidová
- z fosfatidové vychází syntéza živočišných tuků i fosfolipidů
- lyzofosfatidová umí aktivovat malé GTPázy nebo kinázy z rodiny SAR
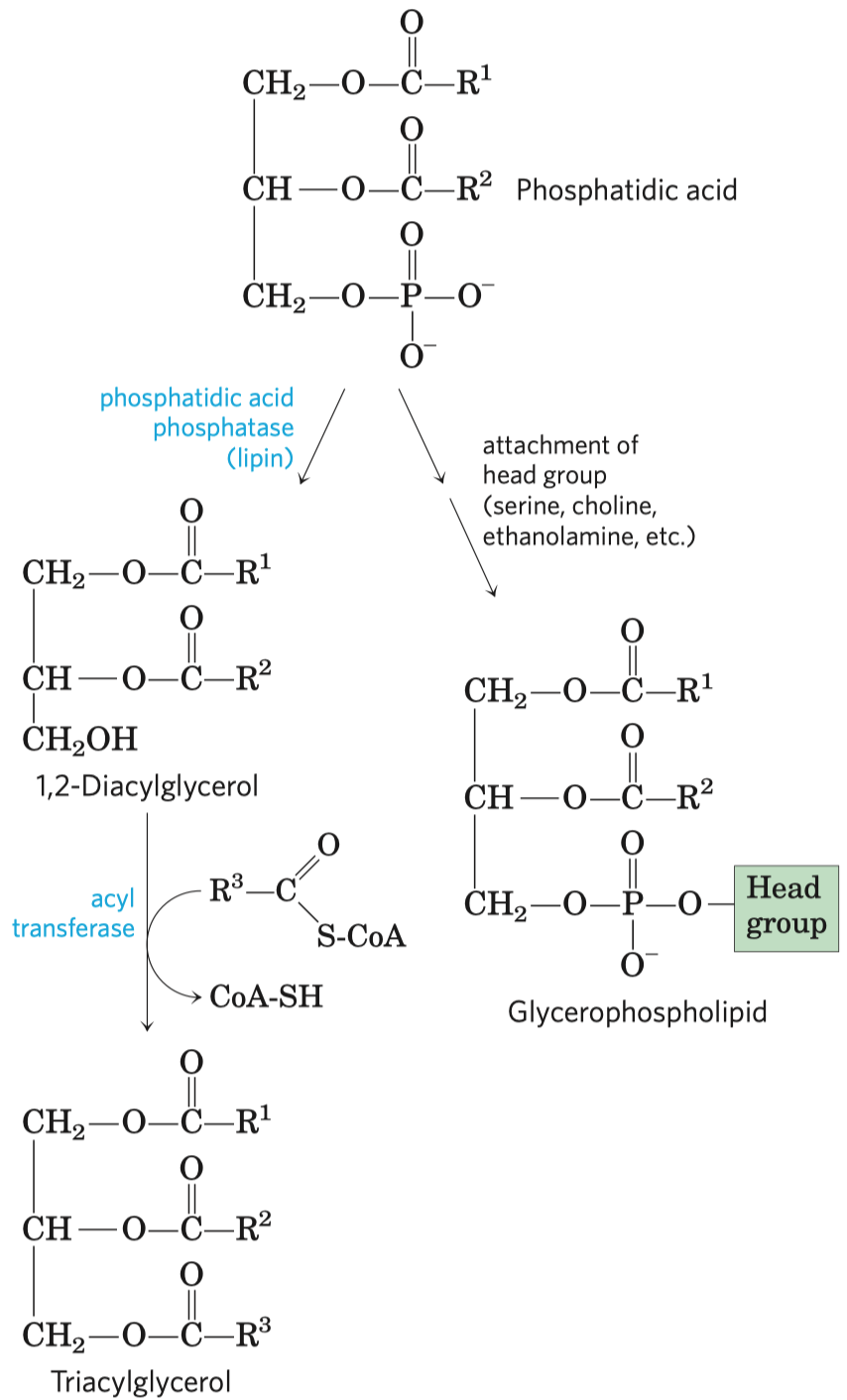
Regulace metabolismu tuků
- syntéza MK je regulována na transkripční úrovni
- při syntéze MK nechceme mít spuštěnou i β-oxidaci, protože by se obě reakce navzájem vyrušily
- existence dvou stavů, buňka má zájem buď na syntéze, nebo na odbourávání
- tento stav je v játrech stimulován inzulínem, buňka chce provádět syntézu
- inzulín stimuluje i expresi
FAS , naopak nenasycené MK tuto expresi inhibují
- inzulín stimuluje i expresi
- když je aktivní
ack , vzniká malonyl-CoA- ten je nejen prekurzorem pro reakci
FAS , ale také inhibuje karnitin-palmitoyl-transferázu I, což je přenašeč MK vmch - β-oxidace neprobíhá, protože se do
mch MK nedostanou
- ten je nejen prekurzorem pro reakci
- tento stav je v játrech stimulován glukagonem a adrenalinem, které aktivují
PKA - v tomto stavu je
ack , která svou činností nepřímo inhibuje β-oxidaci, sama inhibována pomocí AMP- pokles malonyl-CoA \(\rightarrow\) konec inhibice karnitin-palmitoyl-transferázy I \(\rightarrow\) přenos MK do
mch \(\rightarrow\) spuštění β-oxidace \(\rightarrow\) tvorba acetyl-CoA \(\rightarrow\) KC \(\rightarrow\) doplnění ATP
- pokles malonyl-CoA \(\rightarrow\) konec inhibice karnitin-palmitoyl-transferázy I \(\rightarrow\) přenos MK do
Hlavním regulačním mechanismem, který řídí syntézu a degradaci MK, je tedy poměr mezi inzulínem a glukagonem.
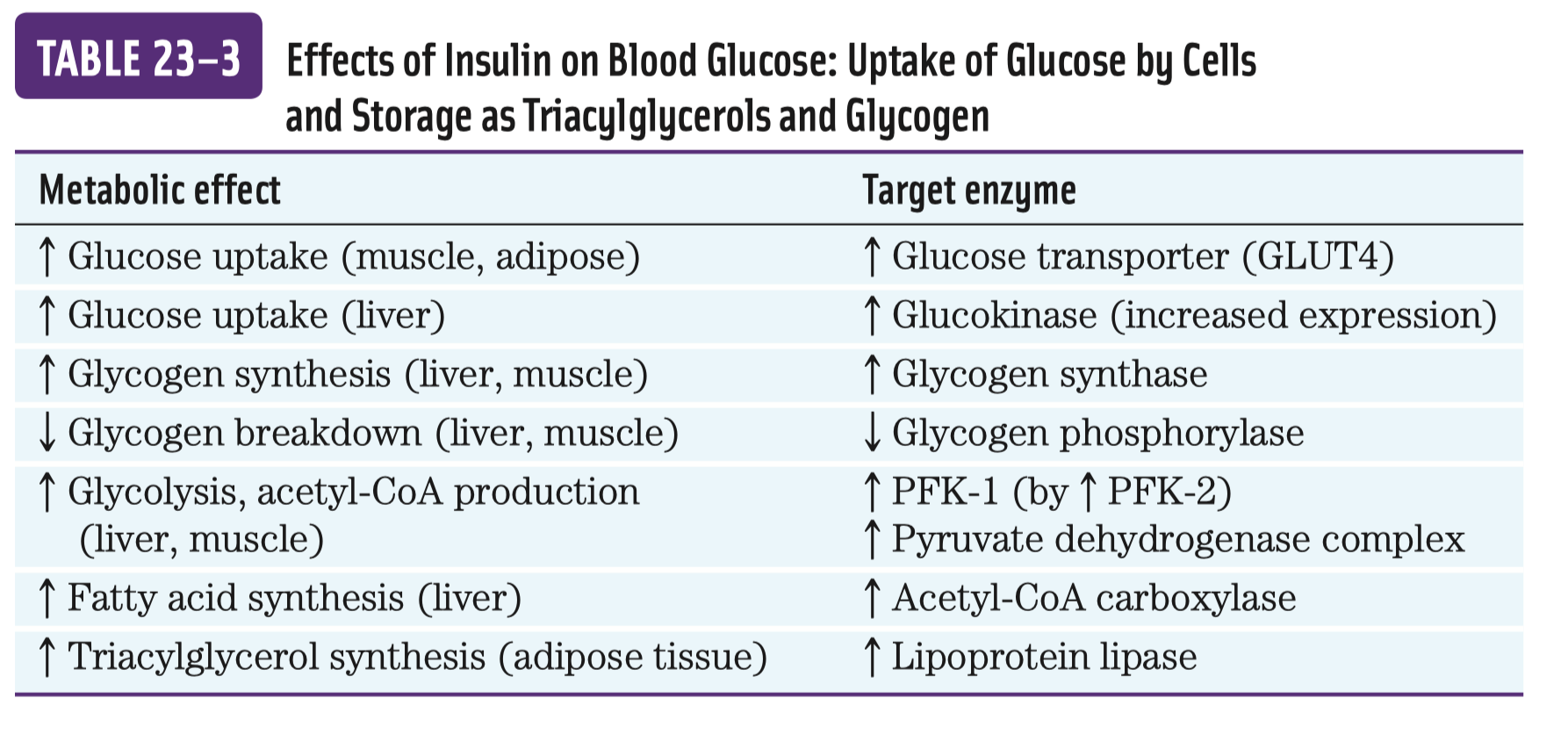
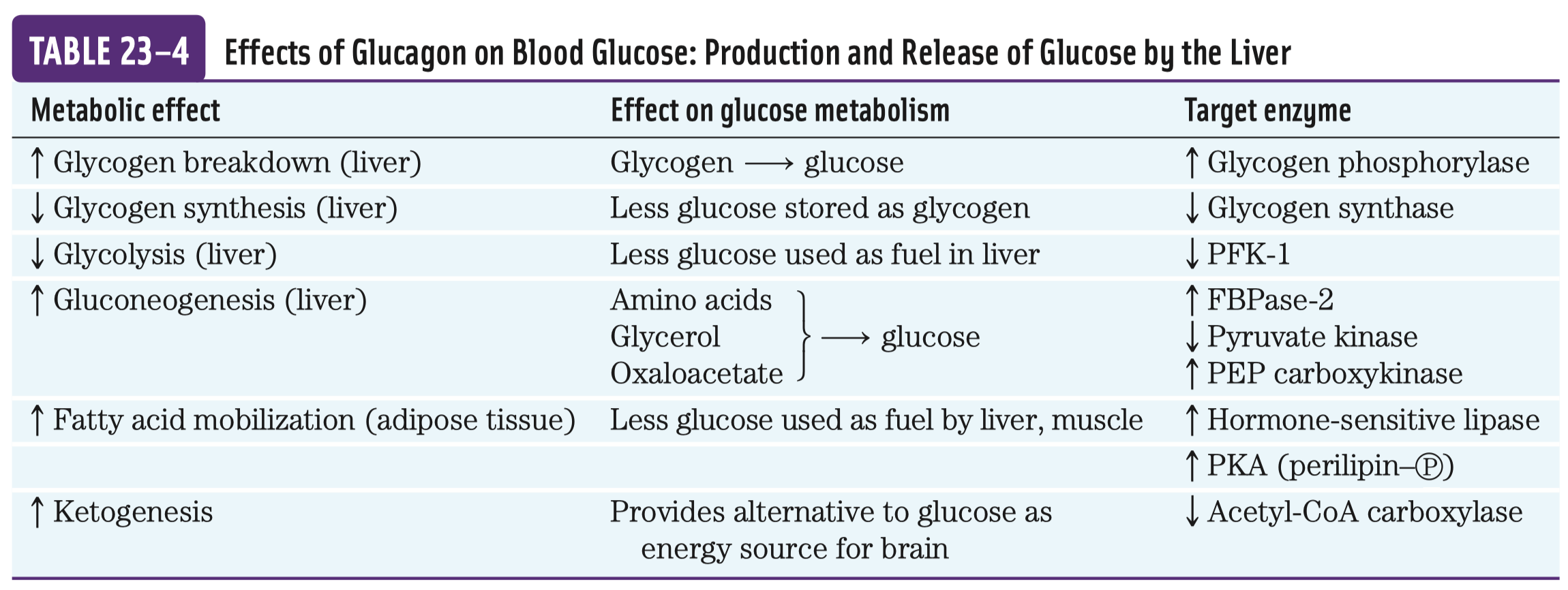
- mechanismus ukládání živočišných tuků
- partikule tuku se z jater dostanou do krve
- zachytí je lipoproteinlipáza na membráně tukových buněk
- odštěpí z partikulí volné MK
- přemění MK na živočišné tuky
- pokud je v tukových buňkách tímto způsobem ukládáno hodně tuků, začnou uvolňovat leptin
- hlavní receptory pro leptin jsou v hypotalamu, který poté různými cestami signalizuje člověku, že je sytý
- patologie leptinu vedou často k obezitě
- leptin také aktivuje AMP-aktivovanou proteinkinázu (dále jen AMPK), která poté v jaterních a svalových buňkách inhibuje
FAS a podporuje β-oxidaci
- hlavní receptory pro leptin jsou v hypotalamu, který poté různými cestami signalizuje člověku, že je sytý
- je schopná v tukových buňkách odbourávat tuky
- reaguje na fosforylaci
PKA (čili vlastně nepřímo na hormonální signály)- snížená hladina glukózy \(\implies\) aktivace, MK poté slouží jako zdroj energie při nízké glykémii
- při dlouhodobě zvýšené koncentraci glukózy je naopak rovnováha posunutá k tvorbě živočišných tuků
Cholesterol
- komplexní steroidní složka
- vzniká z acetátu (potažmo z acetyl-CoA), všechny uhlíky cholesterolu mají původ v acetyl-CoA
- při syntéze vzniká spousta biologicky aktivních látek
- koenzym Q10, který je aktivní např. v OF
- dolichol, přenáší cukerné zbytky při syntéze glykoproteinu
- geranyl, izoprenodní látka, která posttranslačně modifikuje proteiny
- může ucpávat cévy, ale je pro organismus zásadně důležitý
- za nízkých teplot zvyšuje tekutost membrány a za vysokých teplot tuhost membrány
- interferuje s uspořádaným obalem z MK na postranních řetězcích lipidů
- při jeho syntéze vzniká spousta důležitých látek
- mnoho důležitých látek vzinká i přímo z něj
- např. steroidní hormony
- kortikoidy, androgeny, mineralokortikoidy, estrogeny (progesteron, testosteron, estradiol, kortizol, aldosterol)
- např. steroidní hormony
- také z něj vychází syntéza žlučových kyselin, které jsou nezbytné pro účinné trávení tuků
- kyselina glykocholová, taurocholová, cholová
- výhradně v této formě je cholesterol vylučován z těla (jinak se skoro nevylučuje)
Syntéza cholesterolu
První fáze
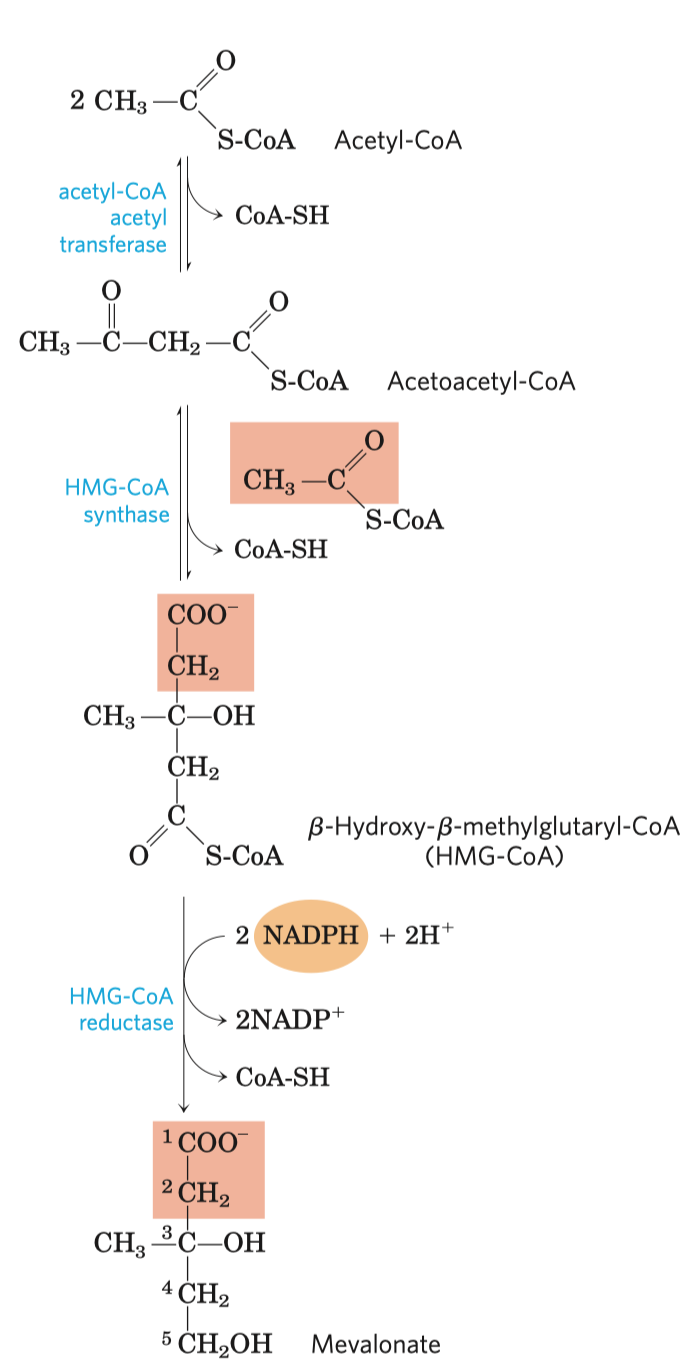
- acetyl-CoA \(\rightarrow\) ketolátka hydroxymetylgutaryl-CoA \(\rightarrow\) mevalonát
- v druhé polovině figuruje HMG-CoA-reduktáza
- přeměna HMG-CoA je hlavní redukční reakcí celé syntézy
- probíhá s pomocí dvou molekul NADPH
- inhibováno fosforylací, a to buďto
PKA neboAMPK - farmaka inhibující tvorbu cholesterolu v těle cílí právě na tuto reakci
Druhá fáze
- mevalonát \(\rightarrow\) 5-pyrofosfomevalonát \(\rightarrow\) izopentenyl pyrofosfát (případně ještě \(\rightarrow\) dimetylalyl pyrofosfát)
- oba možné produkty jsou 5C látky s izoprenovou skupinou
Nyní potřebujeme z vzniklé 5C moleuly vyrobit 30C cholesterol.
Třetí fáze
- ve třetí fázi se spojují produkty druhé fáze, tak, abychom získali 30C skvalen
- izopentenyl pyrofosfát [5] + dimethylalyl pyrofosfát [5] = geranylfosfát [10]
- geranylfosfát [10] + izopentenyl pyrofosfát [5] = farnesyl pyrofosfát [15]
\(2 \times\) farnesyl pyrofosfát [15] = skvalen [30]
- pyrofosfáty se odštěpují a energeticky pohánějí reakci
- při spojení dvou farnesylů se odštěpí
\(\ce{2PP_i}\) , a při tom vždy vznikne reaktivní karbokationt
- při spojení dvou farnesylů se odštěpí
Čtvrtá fáze
- skvalen se zacyklí na lanosterol
- lanosterol se poté v průběhu další devatenácti reakcí přetvoří na cholesterol (multistep na obrázku)
- účastní se toho enzymy asociované s membránou ER
- reakce jsou často oxidacemi, katalýzy se účastní cytochromy z rodiny P450
- tato syntéza je velmi náročná na NADPH
Transport cholesterolu do buňky a jeho regulace
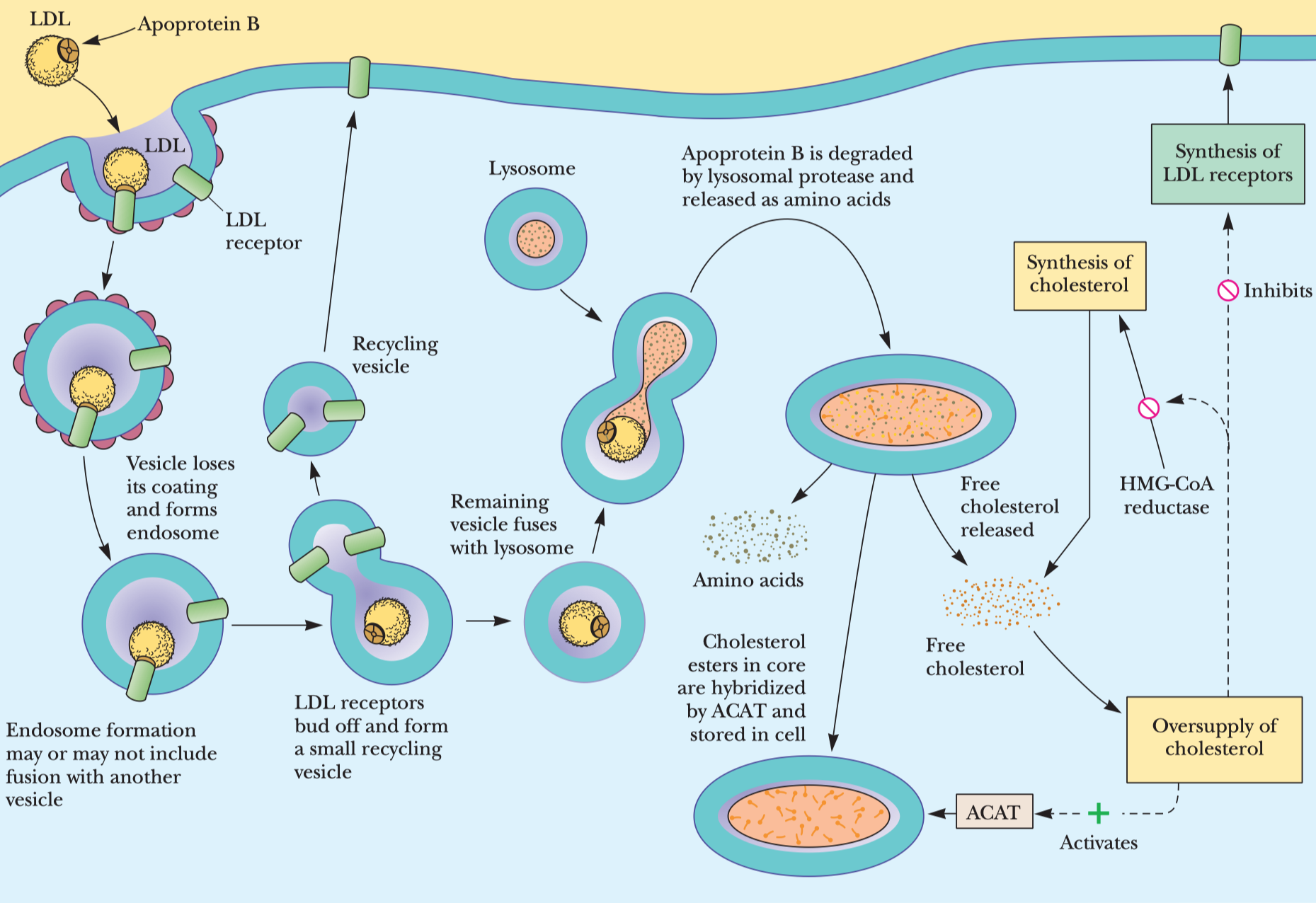
- cholesterol se dovnitř dostává v podobě LDL (low-density lipoprotein) partikulí
- buňka tedy musí mít
LDL receptory- vazba cholesterolu \(\rightarrow\) opláštěný váček \(\rightarrow\) endozom \(\rightarrow\) recyklace (viz obrázek)
- cholesterol v (jaterních) buňkách je zčásti esterifikován a uložen a zčásti se z něj tvoří cholesterolové kapénky
- velké množství těhcto kapének vede k snížení syntézy
LDL receptoru a snížení syntézy HMG-CoA reduktázy
- velké množství těhcto kapének vede k snížení syntézy
Asi 2/3 cholesterolu, který máme v těle, si syntetizujeme a 1/3 přijímáme v potravě. Z těla se dostává výhradně v podobě žluči, žlučových kyselin. Jeho vylučování může podnítit příjem rostlinných fytosterolů.
- normální stav
- játra přijímají hodně
LDL , pak je uvolnují do krve jako VLDL (very low-density lipoprotein) a ony se do nich vrací zase jakoLDL
- játra přijímají hodně
- familiární hypercholesterolémie
- defekt při syntéze
LDL receptorů LDL receptory se špatně vstřebávají a zvyšuje se hladina těch “špatných” cholesterolů v krvi
- defekt při syntéze
- dieta s vysokým obsahem cholesterolu
- receptory jsou ze začátku v pořádku, ale pak dojde k adaptacím, sníží se syntéza HMG-CoA reduktázy
- jaterní tkáň nestíhá cholesterol vstřebávat a zpracovávat a opět to vede k poruchám
- naopak fyzická aktivita vede ke snížení
LDL v oběhu a zvýšení exprese HGM-CoA reduktázy
Ikosanoidy
- někdy také eikosanoidy
- mají dvacet uhlíků
- prostaglandiny, prostacykliny, tromboxany, leukotrieny, hydro-peroxy-ikosatetraenové kyseliny
- jsou v mnohém podobné hormonům, ale jedná se o lokální mediátory
- působí ve velmi nízkých koncentracích, nižších než hormony
- signalizují přes G proteiny a druhé posly, jako je
cAMP - stejně jako hormony ovlivňují řadu biologických dějů
- regulace krevního tlaku, bolest, reprodukční funkce, cyklus spánku a bdění, srážení krve a vlastně skoro jakýkoliv fyziologický proces
- jsou odvozeny od esenciálních mastných kyselin, většinu jsou při jejich příjmu syntetizovány, nebo mohou být přímo přijímány v potravě
- přijmeme esenciální MK, ta se zabuduje do fosfolipidu a z toho je potom uvolňován ikosanoid
- jak už bylo zmíněno v kapitole o MK, MK se někdy značí dvěma čísly (tzv. skóre)
[# uhlíků]:[# dvojných vazeb]- např. 18:2 je kyselina linoelová
- označení ω
\(k\) - dvojná vazba nejvzdáleneší od karboxylu je
\(k\) uhlíků od konce řetězce - podobné jako Δ
\(k\) , což značilo, že dvojná vazba nejvzdáleněší od karboxylu je\(k\) uhlíků od začátku řetězce
- dvojná vazba nejvzdáleneší od karboxylu je
- např. kyselina arachidonová ω6 (20:4), kyselina eikosapentaenolová ω3 (20:4)
- mohou často způsobovat zánětlivé reakce
- na tomto stojí princip kortikoidů: aktivují syntézu lipokortinu \(\rightarrow\) inhibice A-2 \(\rightarrow\) inhibice syntézy ikosanoidů
- kortikoidy ale bohužel inhibují i ikosanoidy, které jsou pro tělo dobré
- na tomto stojí princip kortikoidů: aktivují syntézu lipokortinu \(\rightarrow\) inhibice A-2 \(\rightarrow\) inhibice syntézy ikosanoidů
Tvorba a účinky ikosanoidů
- ikosanoidy se mohou uvolňovat z fosfolipidů
- např. fosfatidylinositol
- fosfolipáza, která ikosanoidy uvolňuje, se jmenuje A-2 (odštěpuje druhý acyl)
- po její aktivaci se uvolní arachidonát a tím může být zahájena syntéza ikosanoidů
- je třeba součástí hadích jedů—v odpovědi na uštknutí se masivně uvolňují ikosanoidy v organismu.
- vznikají v cyklizující (prostaglandiny, PG, a prostacykliny) a linearizující dráze (leukotrieny)
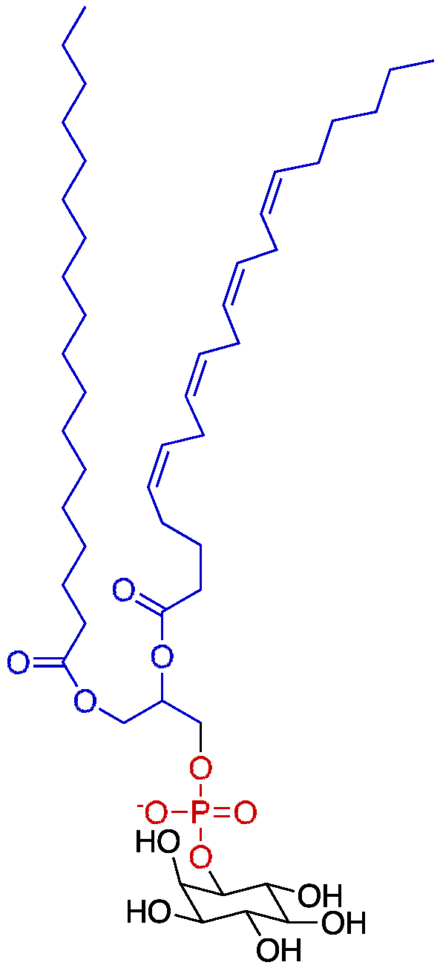
Tvorba ikosanoidů je podobně jako u hormonů spřažena s druhými posly, mohou být aktivovány např. v odpovědi na adrenalin.
- hrají roli v imunitní odpovědi
- chemotaxe (přivolávání) leukocytů
- hrají roli také při alergických reakcích a anafylaktickém šoku
Cyklizující dráha
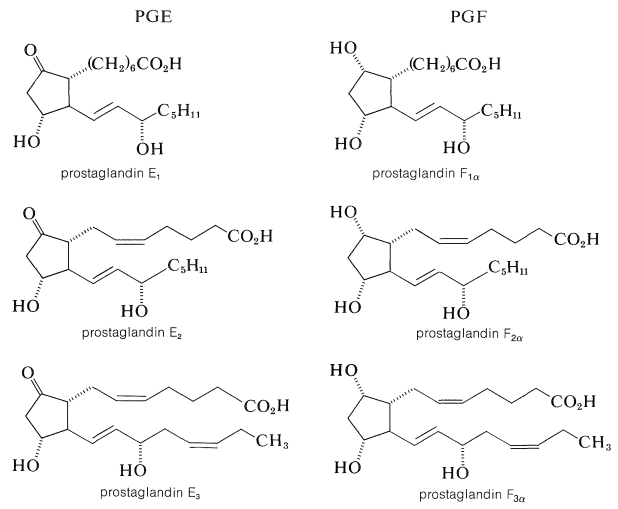
- odvozeny od teoretické kyseliny prostaglandinové
- označují se písmenem a číslem
- písmeno: typ organického cyklu, který se vyskytuje na konci kyseliny
- číslo: počet dvojných vazeb
- malé strukturní změny znamenají velmi odlišné biologické účinky
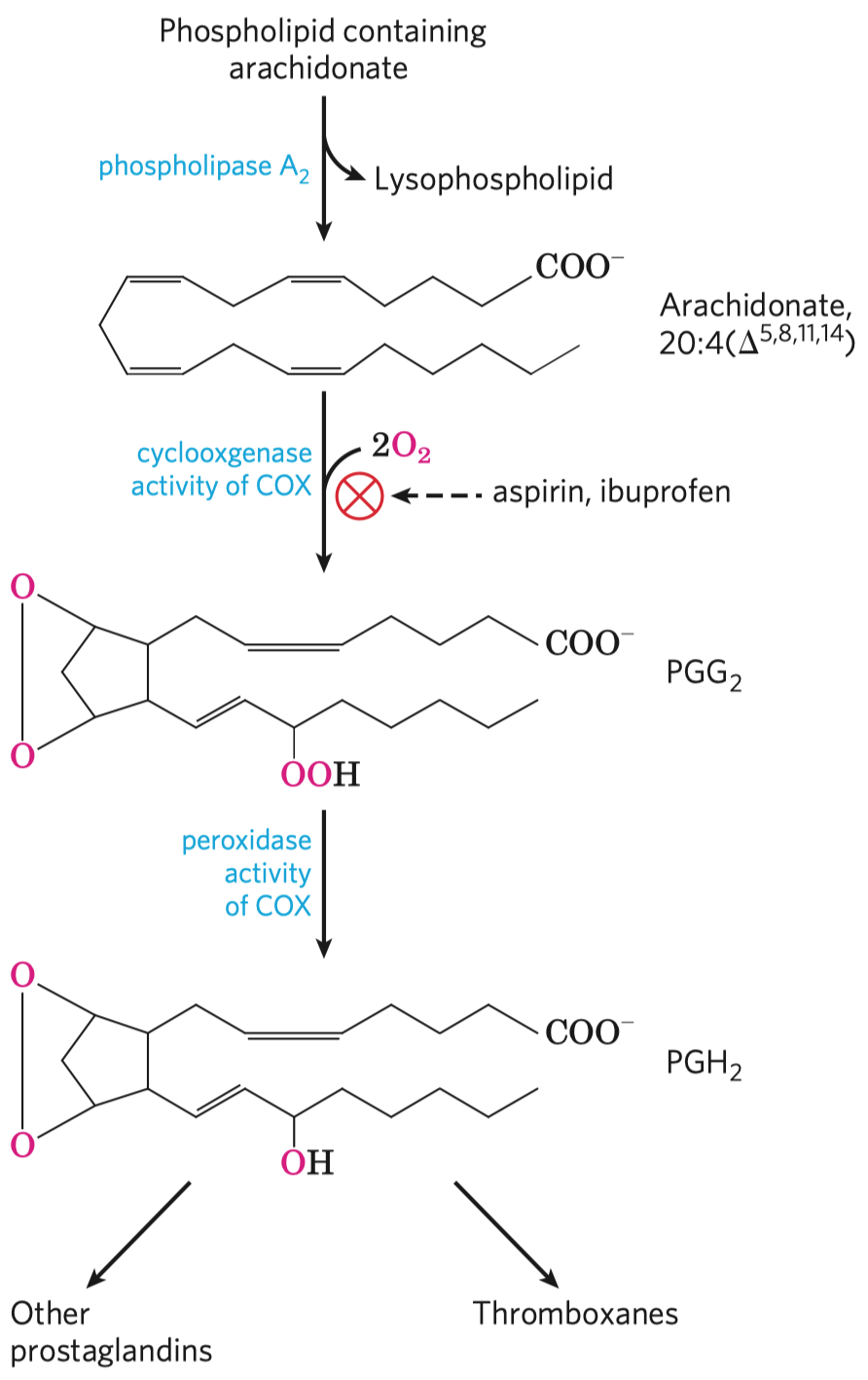
- z arachidonátu je přeměňován prostaglandin-H2 syntázou na
PGH2 - z
PGH2 mohou vzniknout další prostaglandiny a prostacykliny - toto je klíčová reakce
- oficiální název enzymu z předchozí reakce
- má dvě aktivity, cyklooxigenázovou a endoperoxidázovou
- zajímá nás hlavně ta první, cyklooxigenázová, proto se tomuto enzymu častěji říká cyklooxygenáza (COX)
- má dvě formy (izozymy)
- COX-1, nebo též PGH syntáza 1
- konstitutivní, stabilně existuje v těle
- COX-2, nebo též PGH syntáza 2
- inducibilní, tato forma se vyskytuje jen při patologických stavech, jako je např. revmatoidní artritida (chronické záněty)
- COX-1, nebo též PGH syntáza 1
- běžné protizánětlivé látky (např. aspirin) blokují
COX-1 , brání syntézePGH2
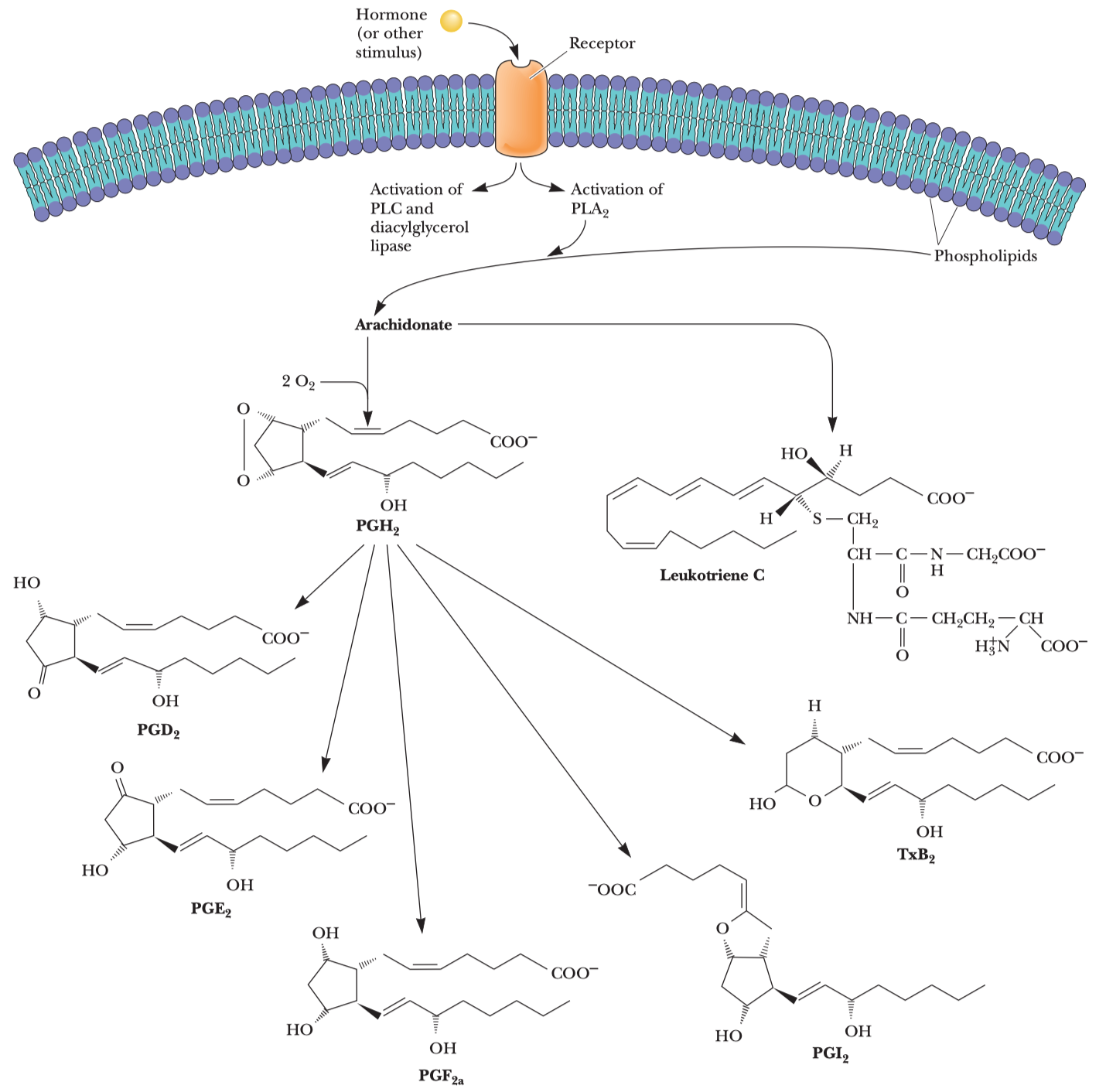
- Prostanoidy
- Podskupina ikosanoidů, která zahrnuje prostaglandiny, tromboxany a prostacykliny.
\(\ce{TXA2}\) - agregace trombocytů
- konratkce hladkého svalstva cév
\(\ce{PGI2}\) ,\(\ce{PGI3}\) - antiagregační účinek
- stimulace relaxace hladkého svalstva
- zvýšení intenzity a trvání bolesti
\(\ce{PGE2}\) - inhibice kontrakce hladkého svalstva
- vasodilatace cév a zvýšení permeability cév
- inhibice sekrece
\(\ce{HCl}\) - stimulace sekrece mucinu
- zvýšení teploty
- zvýšení intenzity a trvání bolesti
\(\ce{PGD2}\) - navození spánku
- kontrakce bronchiálního svalstva
\(\ce{PGF2}\) - kontrakce hladkého svalstva
- zvýšení teploty
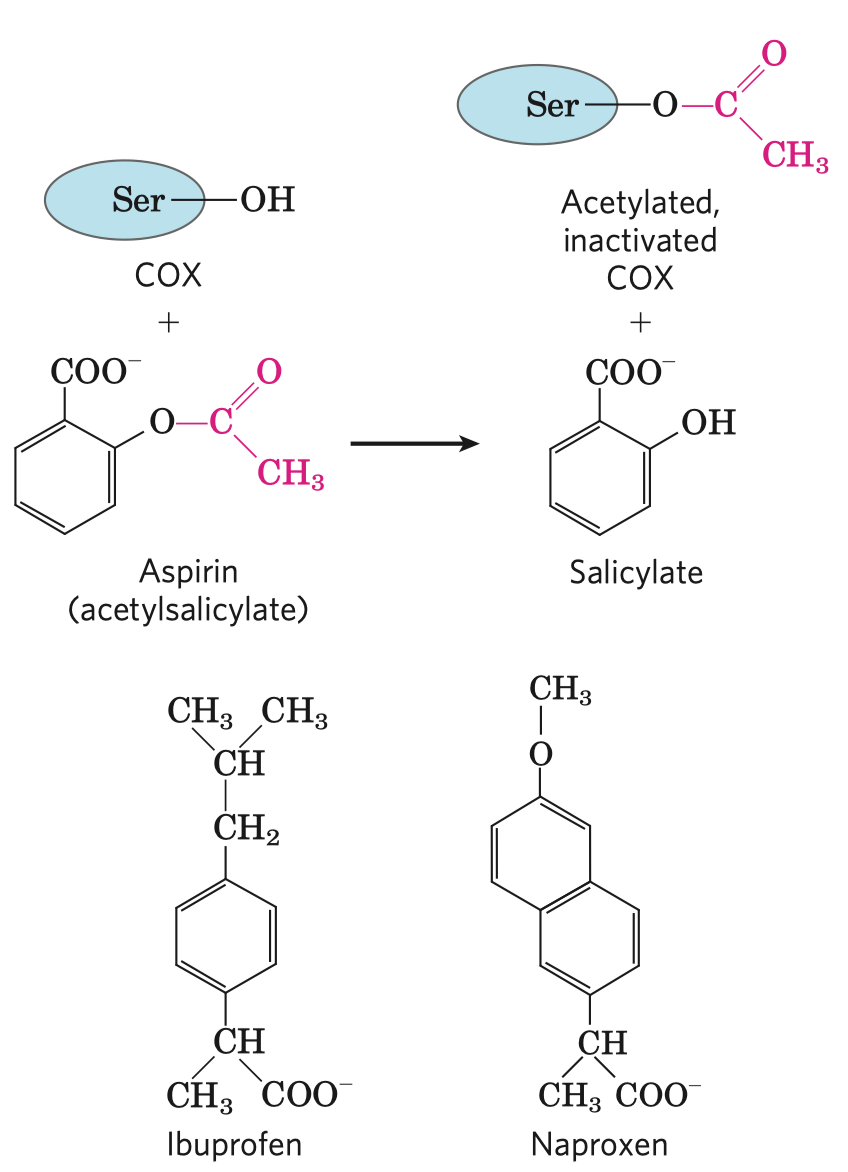
- acetylsalicylová kyselina
- inaktivuje
COX-1 tím, že acyluje jeden serinový zbytek v katalytickém místě na syntáze - doporučuje se brát u starších lidí kvůli prevenci mozkové příhody
- brání tvorbě
PGH2 a tím i prostacyklinu
- brání tvorbě
Glycerolipidy a sfingolipidy
- Glycerolipidy
- Lipidy odvozené od glycerolu.
- Sfingolipidy
- Lipidy odvozené od sfingosinu, 18C alkoholu, jehož první tři uhlíky hrají ve stavbě lipidů roli glycerolu.
- Fosfolipidy
- Podtřída glycerolipidů, mají na glycerolu navázán i fosfor.
- Glykolipidy
- Mají v molekule cukernou složku.
Fosfolipidy
- jsou syntetizovány na membráně ER, přenášeny na vnější stranu cytoplazmatické membrány a pomocí flipáz přenášeny na její vnitřní stranu
- funkce
- kotvení proteinů v membráně (GPI kotva)
- strukturní složka membrán, součást lipoproteinů
- prekurzory spousty věcí, např. inozytoltrifosfátů, triacylglycerolů a druhých poslů
- obsahují dlouhý alkylový řetězec spojený u první skupiny vinyletherovou vazbou a u druhé skupiny etherovou s
\(\ce{C1}\) na glycerolu - z plasmalogenů vzniká faktor, který aktivuje krevní destičky
- jsou hodně v nervové a svalové tkáni, podílí se na zvýšené tekutosti membrán
Syntéza fosfolipidů
- vždycky musí docházet k energetickému nabití jednoho z prekurzorů
- existují v zásadě tři způsoby vzniku
- fosfátový ester je nabitý pomocí CDP
- vzniká fosfatidylethanolamin, neboli fosfatidylcholin
- záměna fosfátového esteru
- fosfatydylethanolamin + serin \(\rightarrow\) fosfatidylserin
- nabití esteru pomocí CDP-diacylglycerolu
- fosfátový ester je nabitý pomocí CDP
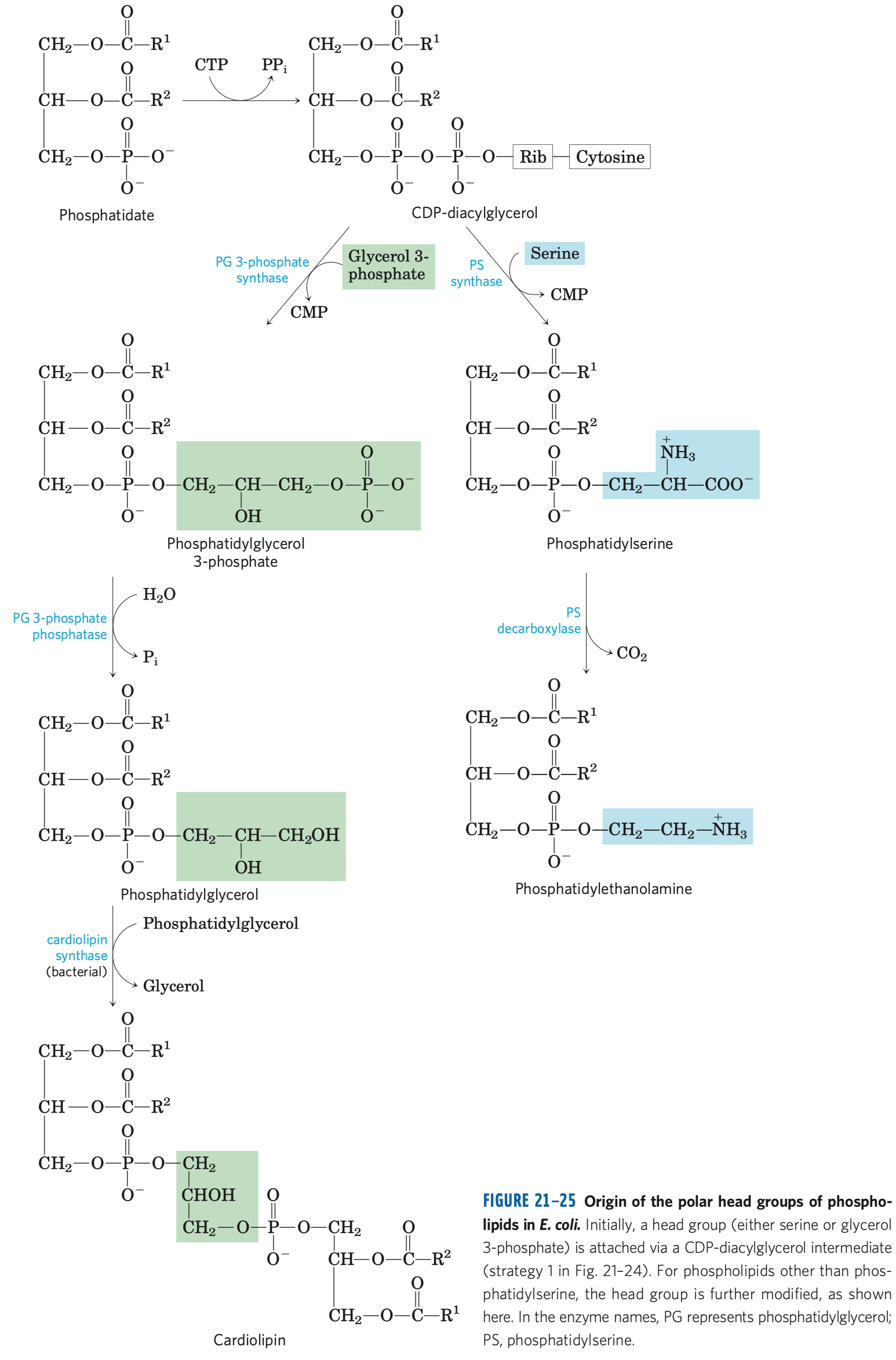
- je důležité přijímat v potravě, podílí se na vodivosti nervových buněk
- může reagovat s ceramidem za vzniku sfingomyelinu, který je důležitý pro tvorbu myelinové pochvy
- alternativně může být syntetizován z fosfoetaloaminu pomocí trimethylace
- důležitá signální molekula
- může být štěpena na druhé posly (IP3 a DAG)
- může z něj vznikat difosfatidylglycerol neboli kardiolipin
- je ve vnitřní membráně mitochondrií a je důležitý pro její správné fungování
- je ho hodně v srdečním svalu
- je nezbytný pro dýchací řetězec
Sfingolipidy
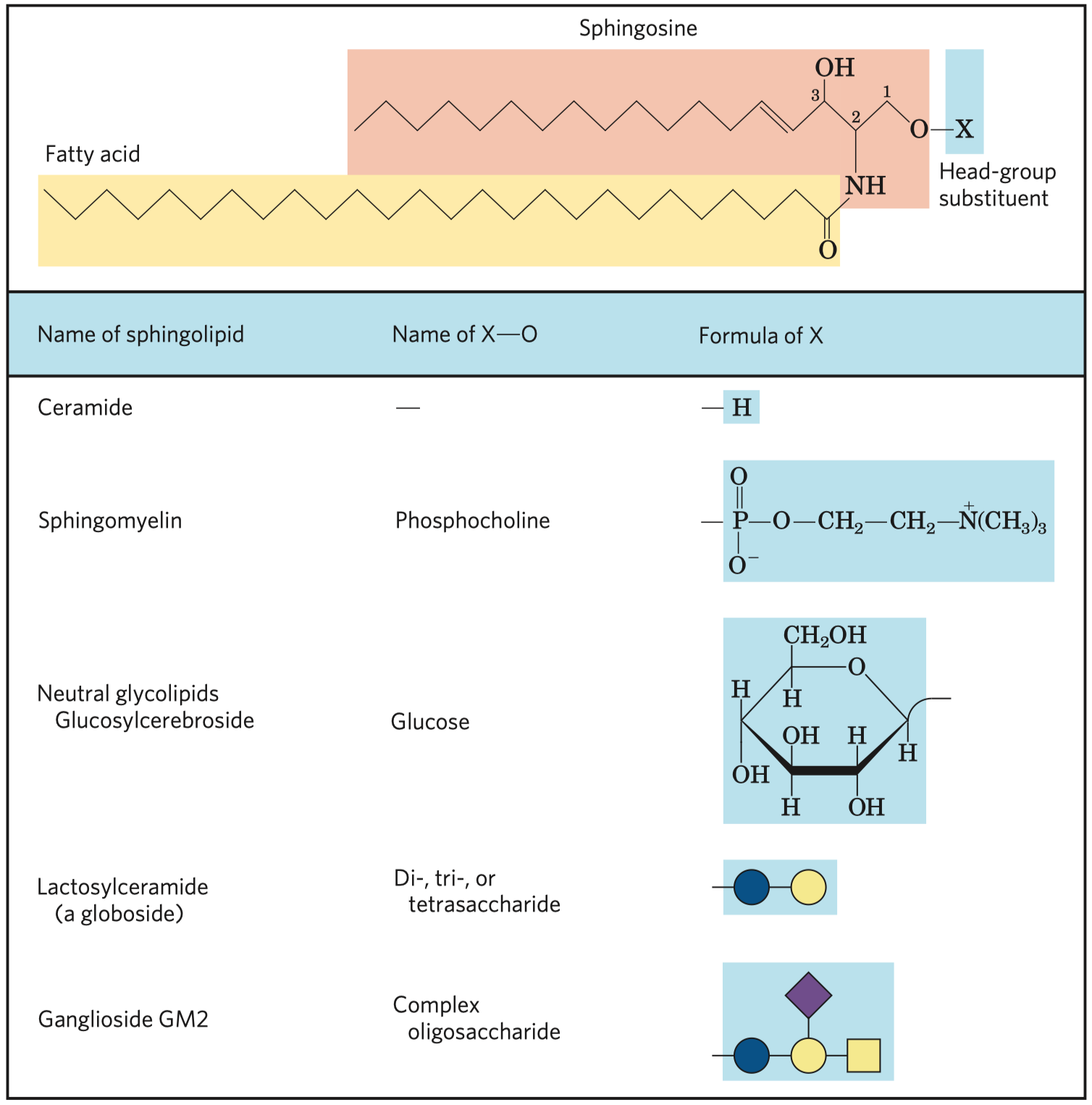
- jsou odvozeny od ceramidu
- ceramid je sfingolipid, který má přes esterovou vazbu připojen ke sfingosinu pouze vodík, viz obrázek
- jejich součástí jsou cukerné zbytky; podle toho, jaké konkrétně, se pak sfingolipidy dále dělí
- cerebrosidy, s jednoduchým cukrem (glukóza, galaktóza)
- sulfatidy (cukr je sulfatován)
- globosidy (mají více cukerných podjednotek)
- gangliosidy (více cukerných podjednotek a ještě kyselina sialová)
- nacházejí se v nervové tkáni
- nikdo nevěděl, co dělají, byly proto nazvány podle mytické sfingy
- glykosfingolipázy (poruchy v glykosfingolipidech) mají často za následek problémy s nervovým systémem, bývají letální
Metabolismus aminokyselin
- amino skupiny se zpracovávají odděleně od uhlíkatých koster AK, viz obrázek
- v katabolických drahách vzniká amoniak, který je pro organismus silně toxický (např. interferuje s buněčnými drahami)
- metabolické produkty k exkreci dusíku se liší podle potřeb daného organismu
- mořští bezobratlí a larvy obojživelníků prostě nechávají volný amoniak difundovat z těla
- pokud má organismus dostatek vody, je možné vylučovat dusík v podobě močoviny
- složitější než prostý amoniak, není ale tak toxická, nepotřebuje tolik vody k vyloučení
- když není k dispozici voda, je možné ji vylučovat v mikrokrystalech nebo v pastě
- další možností je kyselina močová (derivát purinové báze, hypoxanthinu, xanthinu)
- náročná sytéza, viz níže, samotné její vyloučení spotřebuje velice málo vody
- pavouci a škorpióni používají guanin
- transaminace: přenos aminoskupiny z odbourávané AK na nějakou jinou ketokyselinu
- deaminace: samotné uvolnění amoniaku
- zpracování amoniaku a jeho vyloučení (u lidí: cyklus močoviny)
Transaminace
- obecně se při ní přenáší aminová skupina z AK na oxokyselinu, čímž se tato oxokyselina mění na nějakou jinou AK
- v rámci metabolismu AK se uplatňuje tak, že se většina AK přemění na Glu nebo Asp, které se pak dále zpracovávají
- lepší, než kdyby měla každá AK svou vlastní katabolickou cestu
- výjimku tvoří Lys, Thr a Pro, které jsou někdy zpracovány svými příslušnými dehydrogenázami
- transaminace jako taková se skládá ze dvou fází, které obě katalyzuje nějaká transamináza
Obecný sumární popis transaminace je tedy
a pokud bychom ji chtěli rozdělit na fáze, vypadal by průběh takto
- obě fáze jsou si vlastně opačné
- obě navíc musí proběhnout přesně v tomto pořadí, jde tedy o uspořádáné reakce
- akceptorem aminoskupiny (tedy
\(\ce{\alpha-ketokyselina2}\) ) je nejčastěji α-oxoglutarát, viz první příklad transaminace níže, ale mohou to být i jiné látky
Obecný průběh reakce
- někdy též aminotransferázy (v jiných zápiscích byl ještě pojem “aminoenzym”, ale nikde jinde jsem jej nenašel)
- enzymy pohánějící celou transaminaci
- pracují oligospecificky: existují specifické transaminázy pro konkrétní kombinaci AK a oxokyseliny
- všechny ale mají společný koenzym, pyridoxal-5-fosfát (dále jen PLP)
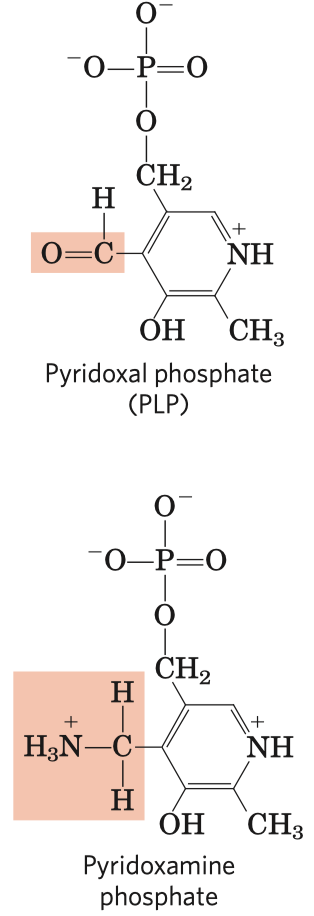
- odvozený od pyridoxaminu (vitamín B6)
- heterocyklická sloučenina s aromatickým charakterem
- je v ní mnoho delokalizovaných π-elektronů, které jsou v rovinách nad i pod rovinou kruhu
- v průběhu první fáze reakce se mění na pyridoxamin-5-fosfát (PMP)
- v průběhu druhé fáze se pak
PMP mění steiným zpsobem zpět naPLP
- v průběhu druhé fáze se pak
- účastní se nejen transaminací, ale také racemací (prohození L-formy za D-formu a naopak) a dekarboxylací, viz obrázek
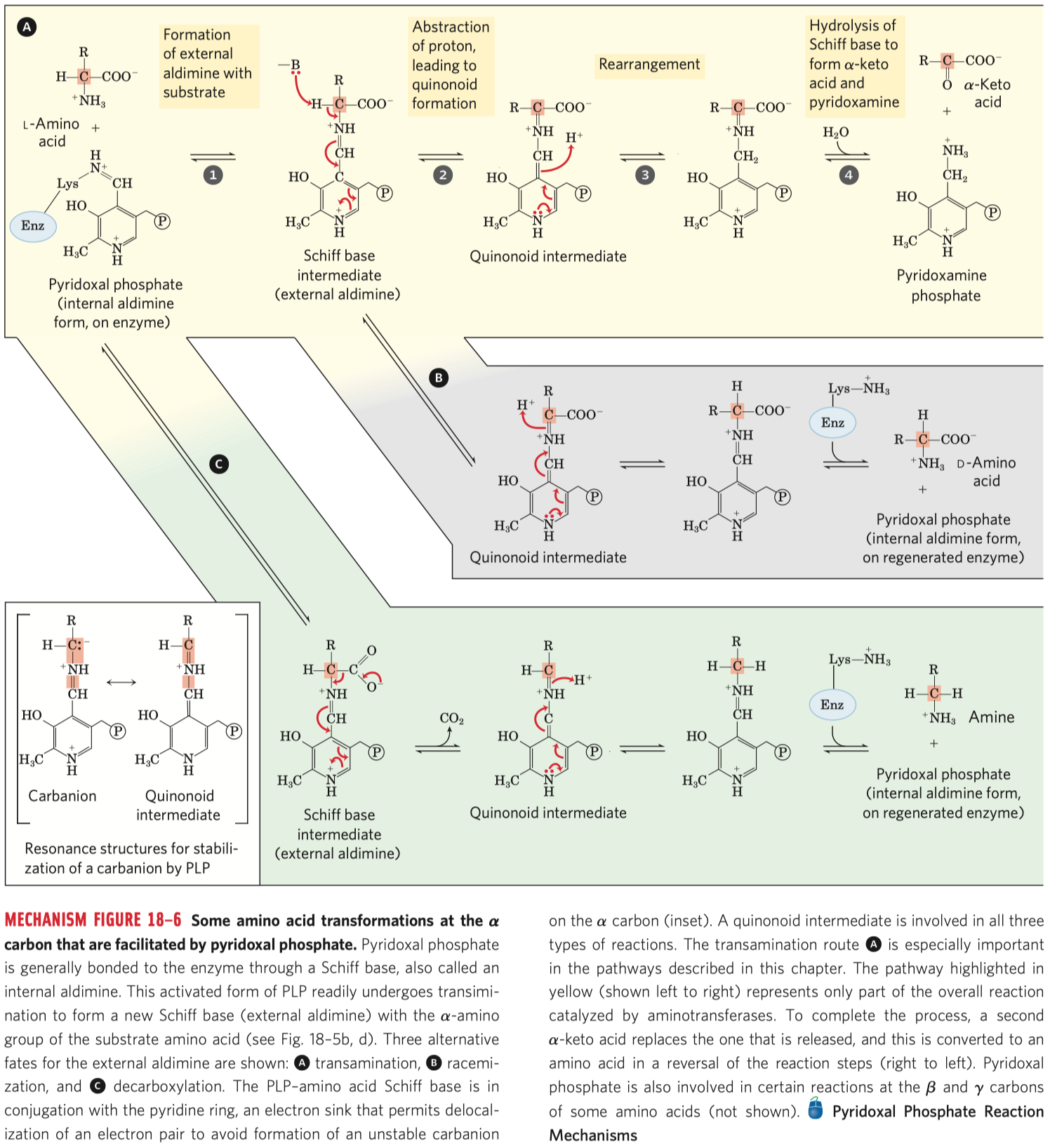
Konkrétní průběh reakce viz obrázek a následující popis.
PLP je na enzym připojen Shiffovou bází přes ε-aminoskupinu lysinu na aktivním cetru enzymu (viz obrázek níže)- kromě Lys se vazby účastní i řada nekovalentních vazeb
- dochází k výměně Shiffovy báze mezi enzymem a substrátem
- máme samotný enzym a poté
PLP přes Shiffovu bázi kovalentně navázané na substrát
- máme samotný enzym a poté
- delokalizované elektrony koenzymu destabilizují vazby na Cα AK, které jsou mimo rovinu kruhu
- je to taková elektronová jímka, která umožňuje štěpení vazeb kolmých na heterocyklus
- vazba
\(\ce{C-NH}\) se štěpí, vznikáPLP a z AK se stane jen α-oxokyselina
Druhá fáze probíhá analogicky, ale od konce;
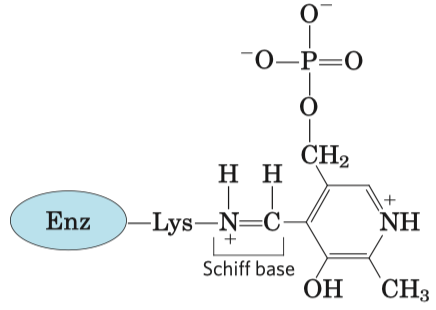
Příklady transaminačních reakcí
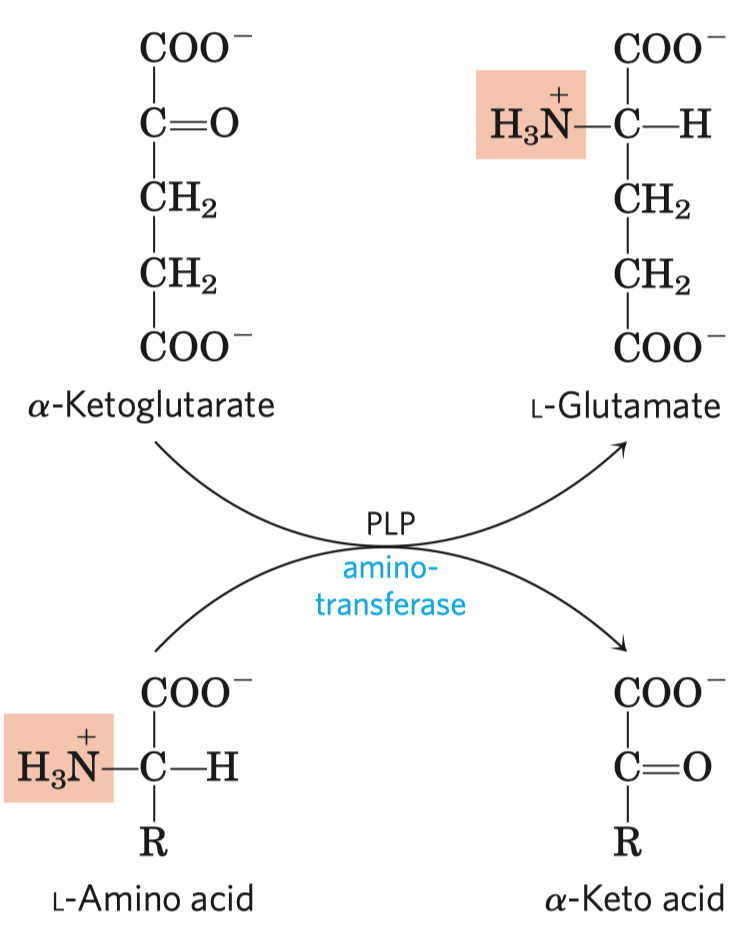
První příklad transaminace:
- většina AK je tímto způsobem přeměněna na Glu
- Lys, Pro a Thr se někdy transaminaci přímo vyhnou
- Asp může být zpracován přímo v močovinovém cyklu, i bez transaminace
- Glu se nemění na Glu (ofc), ale právě na Asp (v reakci níže)
Určité množství Glu se tedy mění na Asp, a to v následující reakci (druhý příklad transaminace):
- hlavní intermediáty metabolismu AK
- všechny AK (s výjimkami) jsou převedeny na Glu nebo Asp a v této podobě dále zpracovány
- výjimku tvoří Lys, Pro a Thr, které někdy místo transaminace projdou reakcí se svou příslušnou dehydrogenázou
Třetím příkladem transaminace je tzv. glukózo-alaninový cyklus.
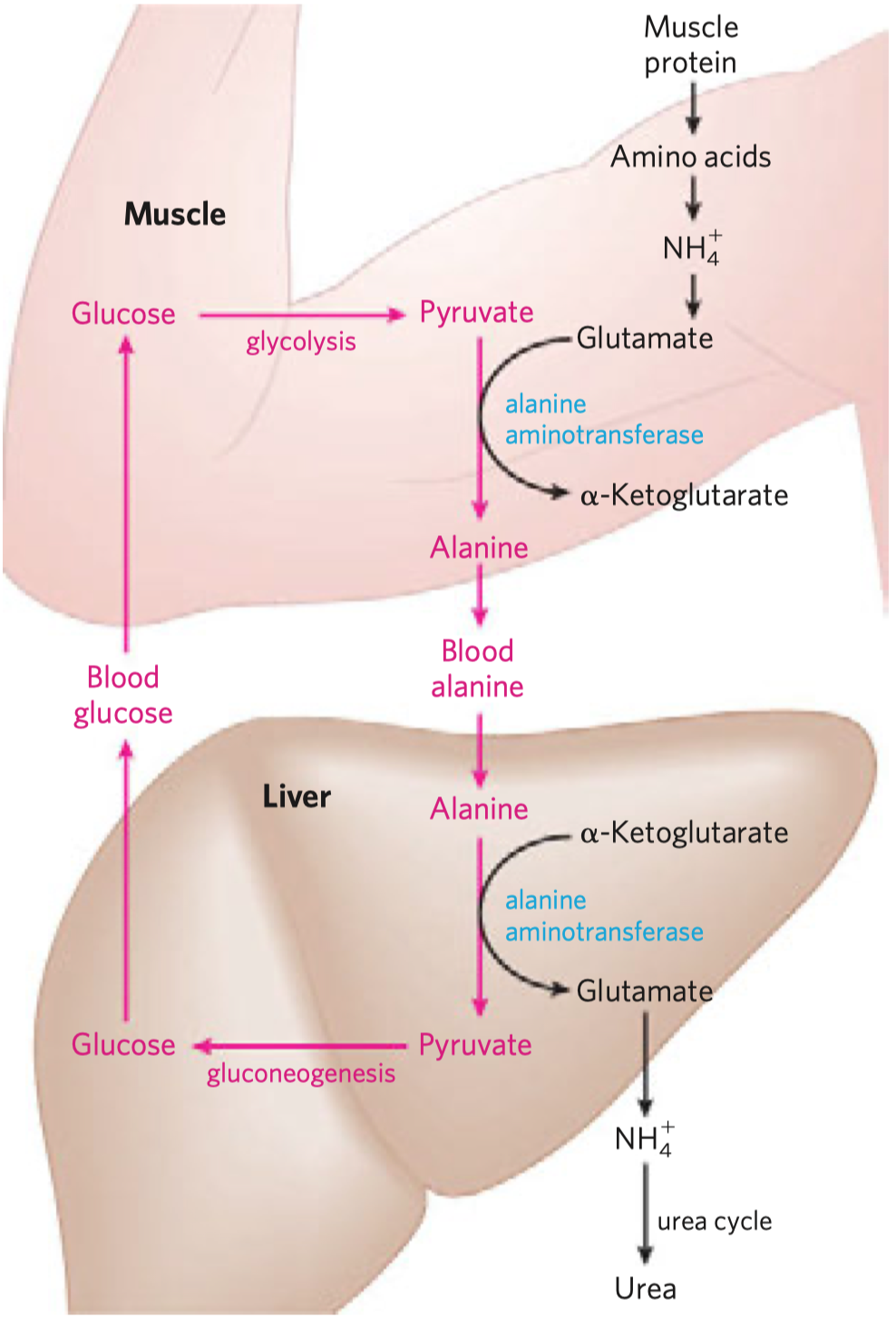
- existují svalově specifické aminotransferázy, které pomáhají netoxicky odstranit dusík z buňky
- pyruvát (jako ketokyselina) + AK \(\rightarrow\) jiná ketokyselina + Ala
- transaminační reakce (Ala je AK odvozená právě od pyruvátu)
- Ala pokračuje do jater, kde může být v reakci výše (za vzniknu pyruvátu) přeměněn na Glu
- pyruvát se poté může v játrech uplatnit např. v
gng , vzniklá glukóza poté může přes krev opět do svalů \(\implies\) cyklus
- pyruvát se poté může v játrech uplatnit např. v
Oxidativní deaminace glutamátu
- reakce, kde se uvolní amoniak
- enzym glutamátdehydrogenáza
- oxidoreduktivní reakce, savčí verze enzymu umí pracovat s
\(\ce{NAD+}\) i\(\ce{NADP+}\) (což je neobvyklé)\(\ce{NAD+}\) se většinou účastní oxidativního metabolismu vmch \(\ce{NADP+}\) naopak bývá účasten cytosolických reduktivních syntéz
- (především) v hepatocytech tak vzniknou amonné ionty
- vzniklé redukované NAD(P)H se využije dále v metabolismu (reduktivní syntézy atp.)
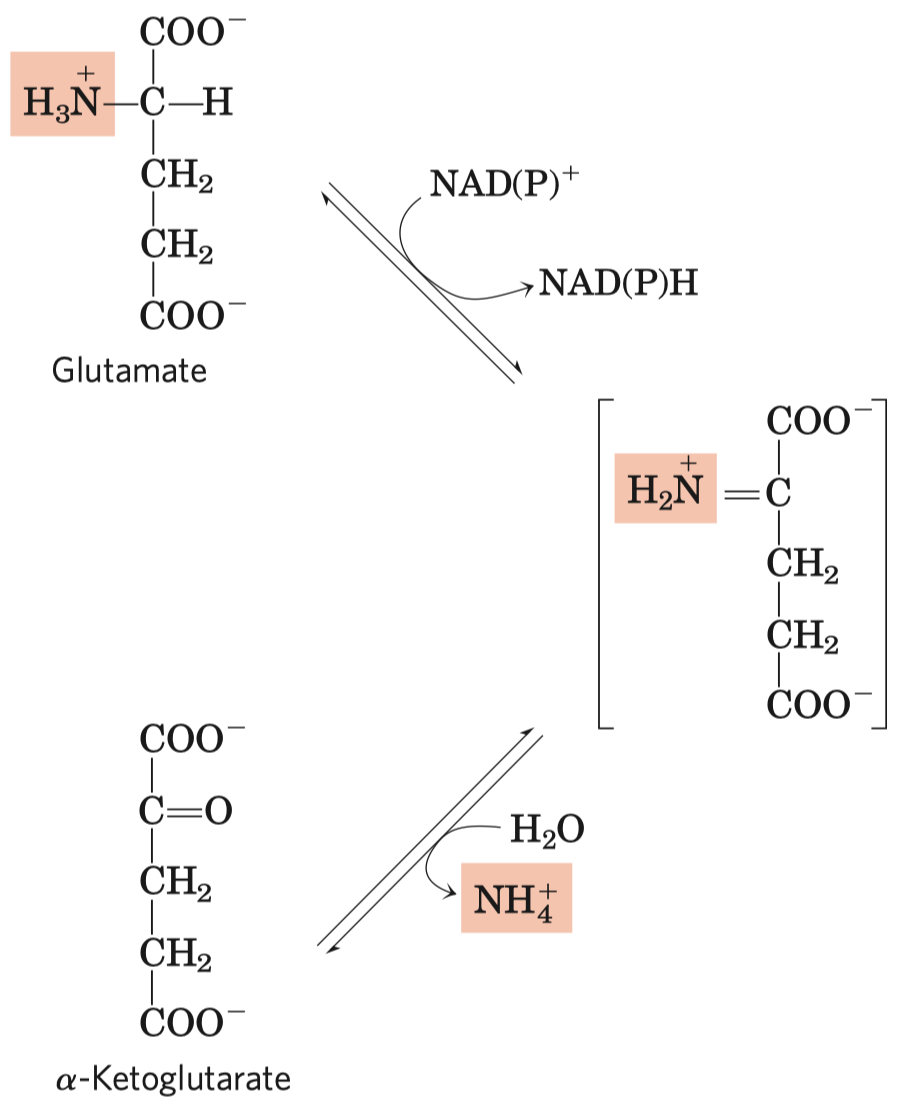
K transportu dusíku se někdy používá také glutamin.
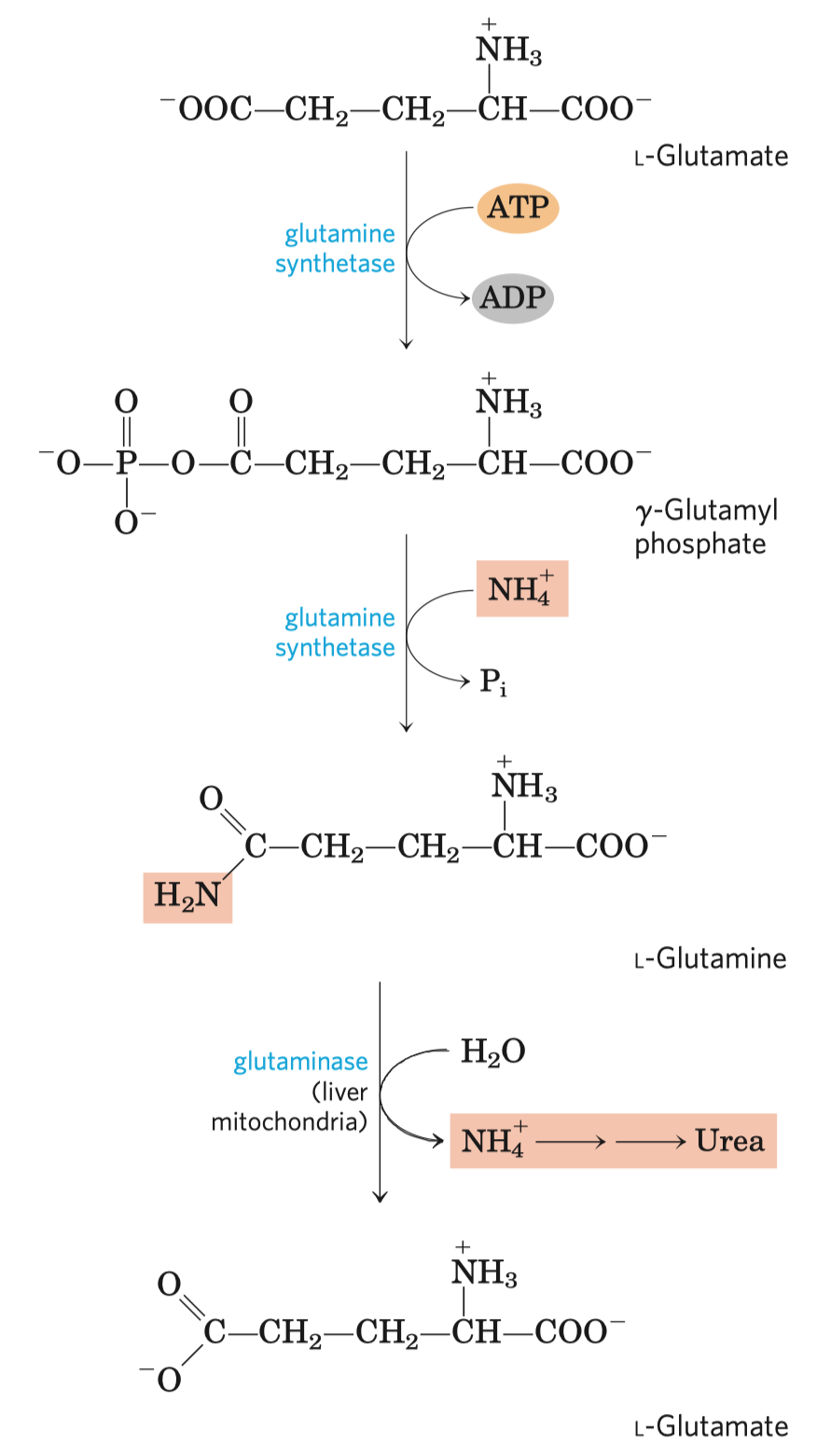
Cyklus močoviny
- objeven Krebsem
- kompartmentalizován mezi mitochondrii a cytoplasmu
- pokud bychom svévolně přidávali nebo odebírali nějaký meziprodukt, změnili bychom tím koncentrace a cyklus by se zastavil
- amoniak z glutamát-dehydrogenázové reakce
- prostřednictvím karbamoyl-fosfátu, dodá první dusík
- kyselina uhličitá (přesněji hydrogenuhličitan)
- kyselina asparagová
- vzniklá transaminací Glu \(\rightarrow\) Asp, dodá druhý dusík
Poté je potřeba ještě 3 ATP (energeticky 4, viz popis druhé reakce).
- močovina (karbamid, urea, diamid kyseliny uhličité)
- fumarát
- ten odnáší tu uhlíkovou kostru, kterou tam přinesl Asp
- pokračuje do KC, nebo do transaminázové reakce, kde se mění na Asp
Průběh
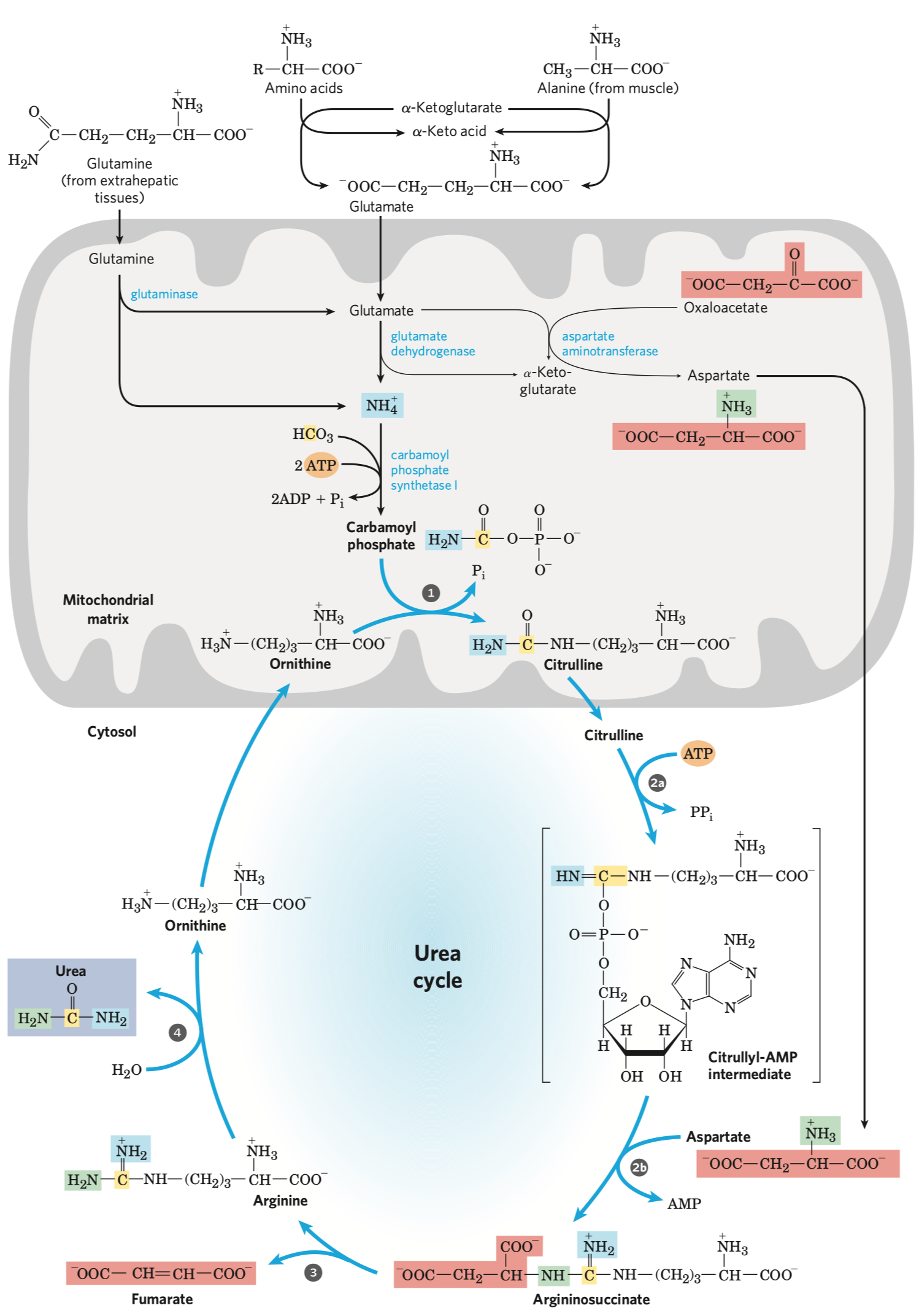
- tvorba karbamoyl-fosfátu v
mch - toho jsou obecně schopny karbamoyl-P syntetáza I a II
- cyklu močoviny se účastní karbamoyl-P syntetáza I
- karbamoyl-P syntetáza II je cytosolická a katalyzuje syntézu purinových nukleotidů
- spotřeba 2 ATP
- katalyzována 2-ornitin-transkarbamoylázou
- ornitin (který v cyklu zbyl z předchozí iterace) + karbamoyl-fosfát \(\rightarrow\) citrulin
- ortinin je podobný Lys, citrulin je podobný Arg
- ani jeden ale není inkorporován v proteinech
- ornitin a citrulin přechází z
mch do cytosolu a zpět
- katalyzována 3-argininosukcinát-syntetázou
- citrulín + příchozivší Asp \(\rightarrow\) arginino-sukcinát
- spotřeba 1 ATP (reakce prochází přes intermediát citrulin-AMP)
- reálně se vlastně dá počítat jako 2 ATP, protože ji poté někdy musíme resyntetizovat
- katalyzována 4-argininosukcinát-lyázou
- štěpení arginino-sukcinátu \(\rightarrow\) Arg + fumarát, který z cyklu vystupuje
- fumarát \(\rightarrow\) malát \(\rightarrow\) oxaloacetát \(\rightarrow\) vstup do
mch \(\rightarrow\) KC (nebo transaminázová reakce \(\rightarrow\) Asp)
- fumarát \(\rightarrow\) malát \(\rightarrow\) oxaloacetát \(\rightarrow\) vstup do
- katalyzována 5-arginázou
- štěpení argininu \(\rightarrow\) uvolnění karbamidu (ureová skupina) + ornitin
Metabolismus C-kostry AK
Nyní se zabýváme tím, co se stane s uhlíkovou kostrou AK, která nám zůstala po deaminaci.

- základní rozlišení intermediátů, na kterých končí dráhy odbourávání AK
- oxokyseliny vzniklé z různých AK se ubírají různými metabolickými drahami a nakonec konvergují do jedné z pěti látek jejímž prostřednictvím se dostanou do KC—tyto “konečné” látky se dále dělí
- ketogenní látky
- 2C látky, které se nemohou se účastnit
gng , protože o oba uhlíky přijdou v dekarboxylacích - účastní se tedy pouze syntézy ketolátek
- konečnými látkami jsou acetyl-CoA nebo acetoacetyl-CoA
- 2C látky, které se nemohou se účastnit
- glukogenní látky
- >2C látky, které vstupují do cyklu až po dekarboxylaci a jejich uhlík tedy může být využit v rámci
gng - pyruvát, oxoglutarát/ketoglutarát, sukcinyl-CoA, fumarát, oxaloacetát
- >2C látky, které vstupují do cyklu až po dekarboxylaci a jejich uhlík tedy může být využit v rámci
- ketogenní látky
- AK, které se rozkládají výhradně na ketogenní látky
- pomůcka: všechny, které začínají na L
- Lys, Leu
- AK, které se někdy rozkládají na ketogenní i na glukogenní látky
- pomůcka: PITTT
- Phe, Ile, Tyr, Trp, Thr
- AK, které se rozkládají výhradně na glukogenní látky
- to je ten zbytek
Následuje výčet sedmi skupin, do kterých se AK podle svých koncových produktů (a jiných okolností) rozřazují.
Ala \(\rightarrow\)pyruvát Cys \(\rightarrow\)pyruvát Gly \(\rightarrow\)Ser Ser \(\rightarrow\)pyruvát Thr \(\rightarrow\)Gly +acetyl-CoA
Důležitým koenzymem je zde
Glu \(\rightarrow\)2-oxo-glutarát Arg \(\rightarrow\)Glu Gln \(\rightarrow\)Glu His \(\rightarrow\)Glu Pro \(\rightarrow\)Glu
Gln je konvertován konvertázou na Glu.
Leu \(\rightarrow\)text +acetyl-CoA Ile \(\rightarrow\)sukcinyl-CoA +acetyl-CoA Val \(\rightarrow\)sukcinyl-CoA
Klíčovou dráhu metabolismu katalyzuje oxo-izovalerátdehydrogenázový komplex.
- podobný pyruvát-dehydrogenázovéhu komplexu a také oxoglutarát-dehydrogenázovému komplexu (z KC)
- katalyzuje oxidativní dekarboxylaci pyruvátu
- dochází k přenosu dvouhlíkatého zbytku na CoA
- multienzymový komplex, tři hlavní enzymové aktivity
Nejenže zde najdeme enzym podobný enzymům z KC, ale některé rozkladné reakce této skupiny jsou analogické odbourávání alifatických řetězců v MK.
To byly tři největší skupiny. Následuje výčet těch zbývajících.
Lys \(\rightarrow\)acetoacetát Trp \(\rightarrow\)Ala +acetyl-CoA
- nejdelší a nejsložitější reakce
- oxoadipátdehydrogenázový komplex je další ze skupiny dehydrogenázových komplexů (již čtvrtý)
- typickým produktem je acetoacetát
Asp \(\rightarrow\)oxalacetát Asn \(\rightarrow\)oxalacetát
Transaminacemi a deaminacemi jsou převoditelné přímo na oxalacetát, již intermediát KC.
Met \(\rightarrow\)sukcinyl-CoA
- je v ní pouze Met, sám
- v rámci jeho metabolismu vzniká sloučenina S-adenosylmethionin (dále jen SAM)
- prekurzor pro biologické methylace
Phe \(\rightarrow\)fumarát +acetoacetát Tyr \(\rightarrow\)fumarát +acetoacetát
- průběh katabolismu zahrnuje oxygenázové reakce (s kyslíkem)
- uplatňuje se unikátní mechanismus, tzv. NIH přesmyk
Skupina [A, C, G, S, T]
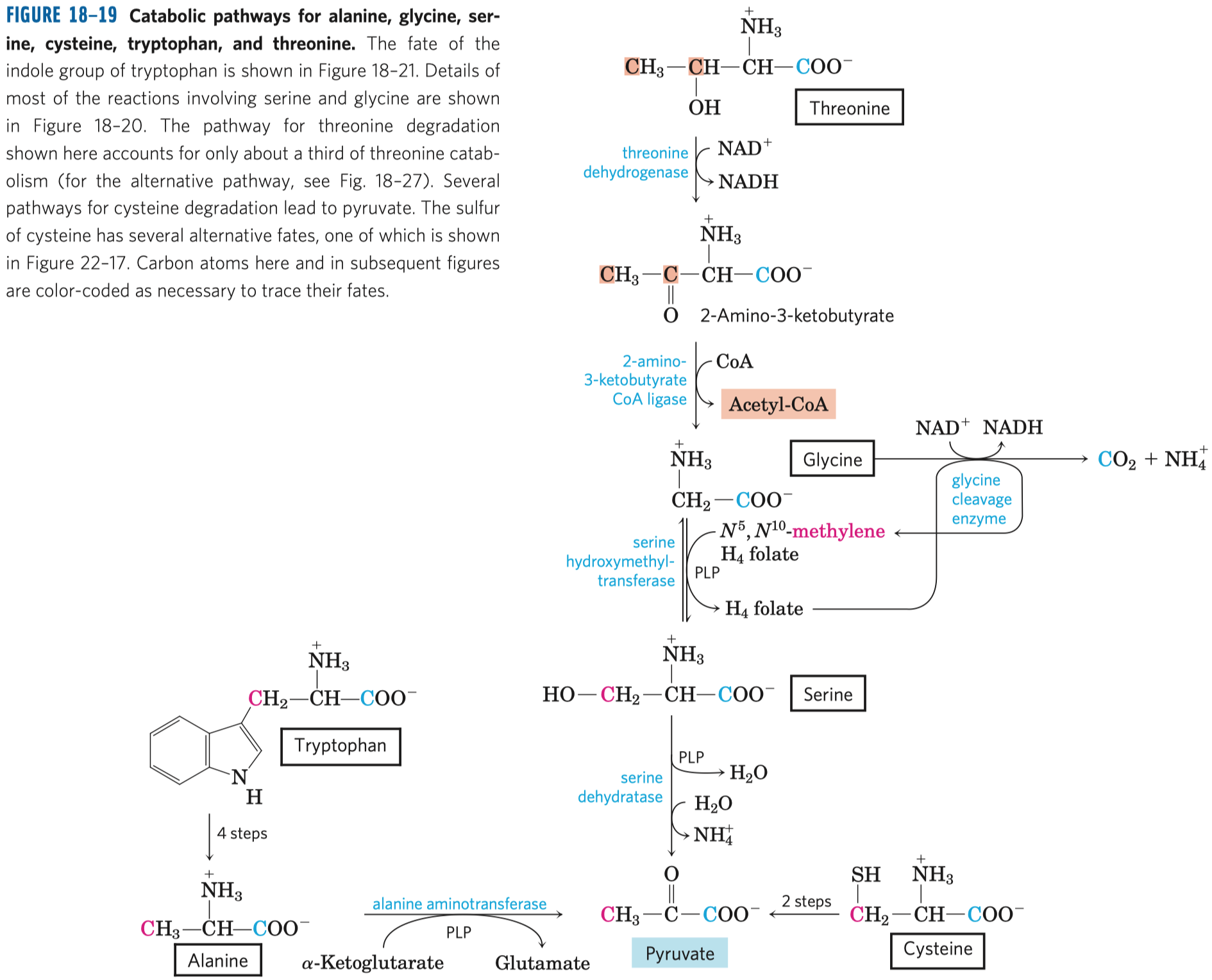
- Cys \(\rightarrow\) pyruvát
- existuje více drah, řídí se ale podobnými strategiemi
- Ala \(\rightarrow\) pyruvát
- prostá deaminace
- Ser \(\rightarrow\) pyruvát
- reakce serin-hydroxymethyltransferázy, která spolupracuje s
PLP - i Ser je relativně jednoduše převoditelný na ketokyselinu
- reakce serin-hydroxymethyltransferázy, která spolupracuje s
- Thr \(\rightarrow\) Gly (+ acetyl-CoA)
- složitější
- katalyzováno serin-hydroxymethyltransferázou a
PLP
- Gly \(\rightarrow\) Ser (potažmo \(\rightarrow\) pyruvát)
- opět katalyzováno serin-hydroxymethyltransferázou
THF systém
- tato reakce přesahuje metabolismus AK
- pomocí rozložení Gly a tetrahydrofolátu (dále jen THF) zásobuje organimus jednouhlíkatými zbytky
- molekula Gly se rozebere na prvočinitele, amonný iont, oxid uhličitý, zbylý uhlík se ve formě methylenové skupiny ocitá jako součást
THF - reakci katalzuje vícepodjednotkový systém, ne však přímo komplex
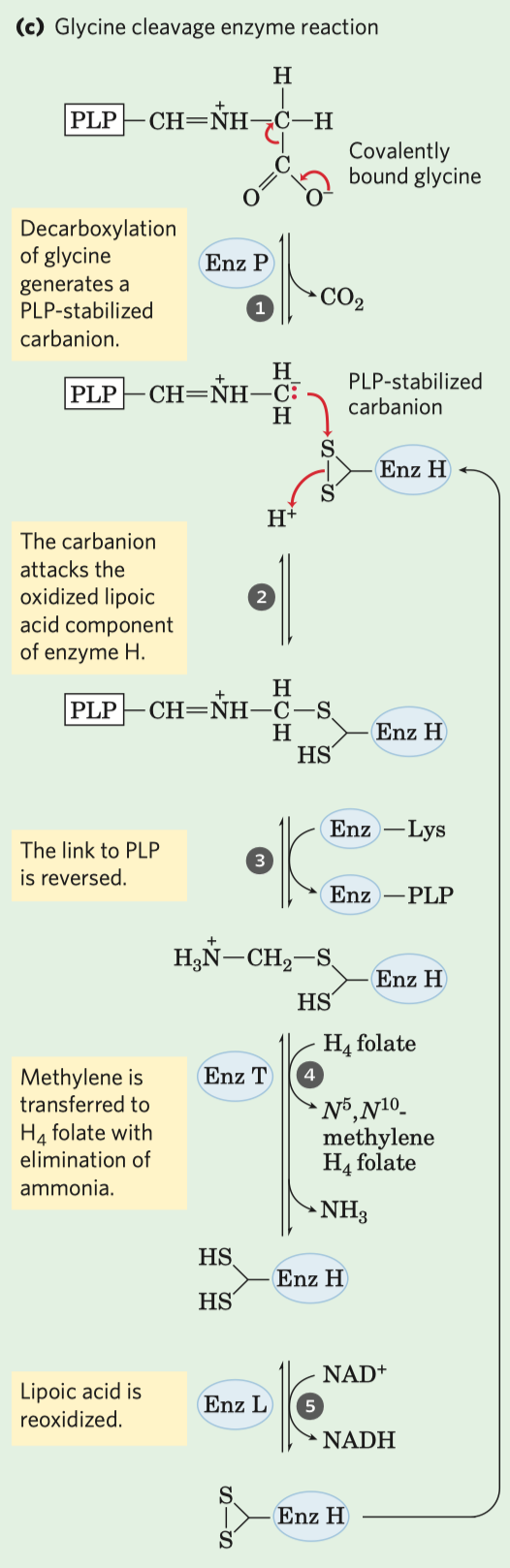
THF vytváří Shiffovu bázi sPLP - Gly je za pomoci
PLP štěpen, uvolňuje se\(\ce{CO2}\) - amino-methylová skupina, která zbyde po štěpení Gly, je přenášena na rameno
- uvolňuje se amoniak, zatímco methylen je přenesen na
THF
THF je koenzym, který je pro nás esenciální (v podobě kyseliny listové)- derivát pteridinu, který ještě obsahuje kyselinu p-aminobenzovou a nějaké zbytky z Glu vázané izopeptidovou vazbou
- metylace kofaktoru bude kromě štěpení Gly probíhat i během reakce Ser \(\rightarrow\) Gly, který katalyzuje hydroxymethyltransferáza
- z methylu-
THF může být vyroben methylen-THF a z něj methenyl-THF - methylen-
THF \(\rightarrow\) methyl-THF nás stojí jedno NADH, je to redukční reakce - methylen-
THF \(\rightarrow\) methenyl-THF je naopak oxidace, dostáváme se tím do metabolismu purinu
- methylen-
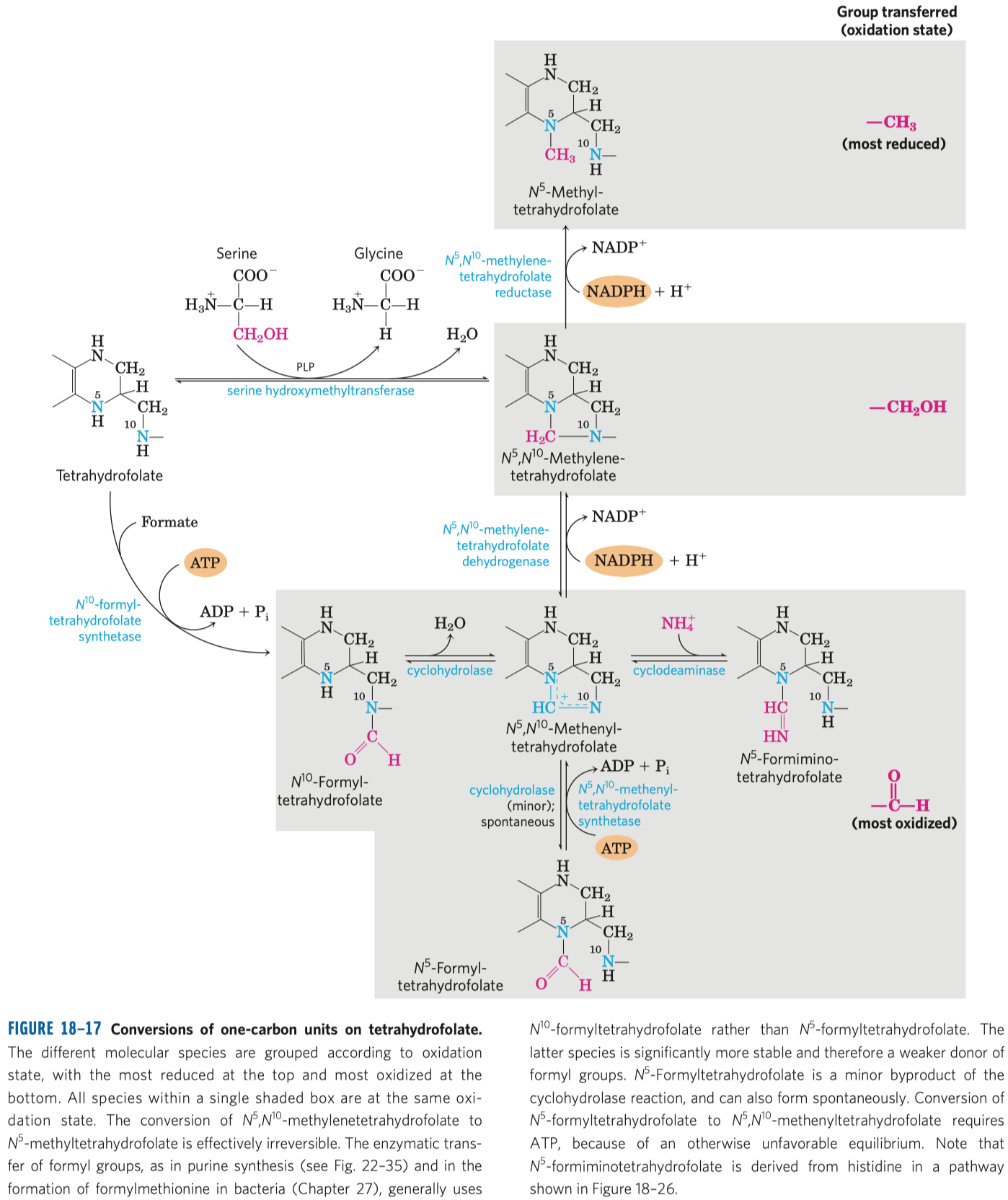
A proč potřebujeme nějaký přenašeč jednouhlíkové skupiny?
- nezbytný pro biologické methylace
- syntéza RNA a DNA (puriny)
- buněčné dělení
- funguje jako soustava rezervoárů, které nesou uhlíkaté zbytky různého oxidačního stupně interkonvertovatené mezi sebou navzájem
Skupina SAM
- k syntéze Met budeme potřebovat methyl-
THF a homocystein- homocystein je také AK, není však běžně v proteinech
- probíhá tzv. cyklus aktivovaného methylu
- slouží k regulaci biologických methylací
- mimo to slouží jeden jeho intermediát (homocystein) k syntéze cysteinu
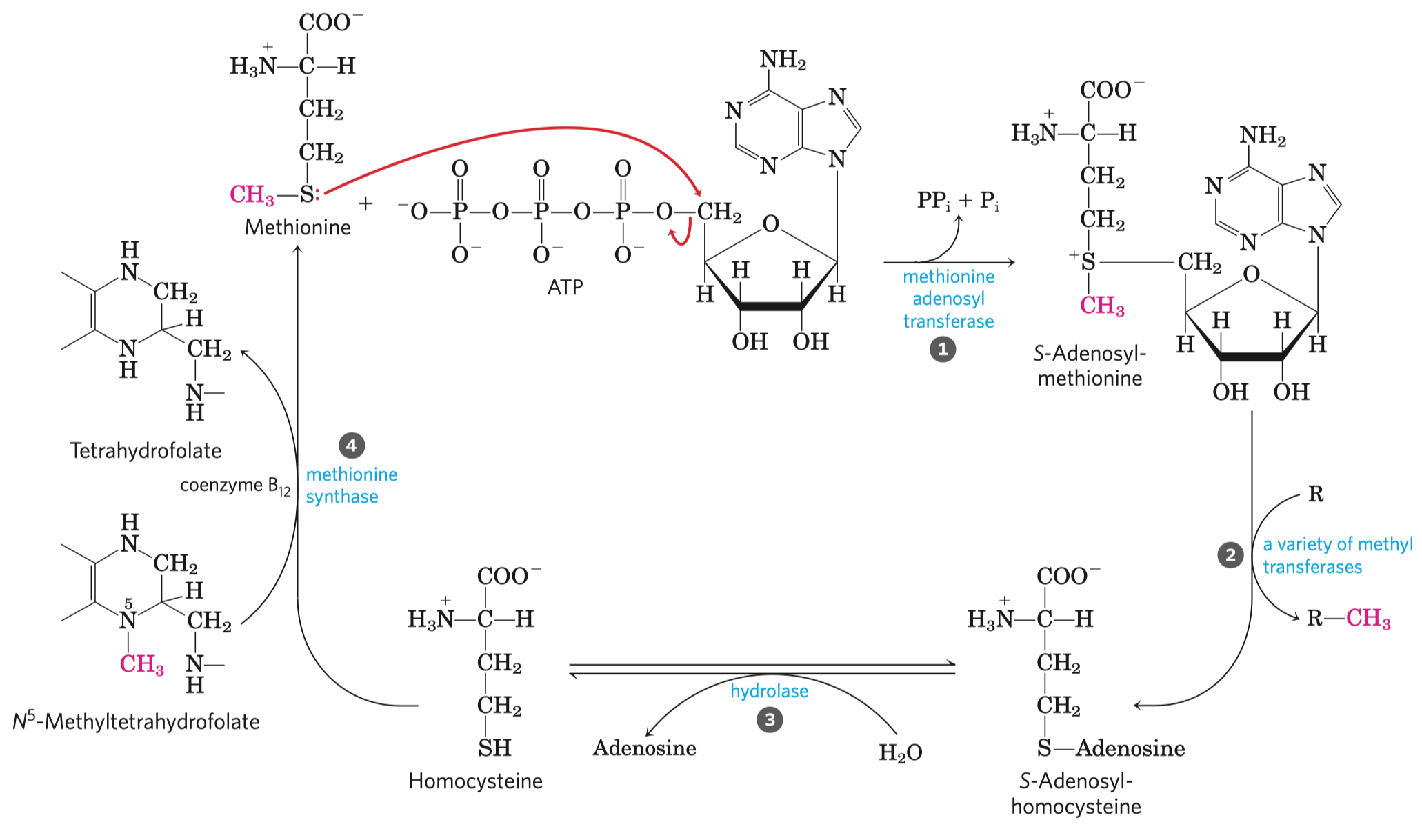
- Met se váže na ATP za vzniku
\(\ce{PP_i + P}\) aSAM - je zajímavé, že se z ATP uvolní všechny tři fosfáty, to se děje už jen v jedné další reakci
SAM něco methyloval \(\rightarrow\) vznikl S-adenozylhomocystein
- hydrolýzou se uvolňuje homocystein
- pomocí
THF opět vznikne Met
- B6 (biotin), B12: vitamíny, koenzymy, které jsou důležité pro průběh reakcí
- B12 je nezbytný pro zajištění průběhu reakcí zajišťujících homocystein \(\rightarrow\) Met
- kromě této reakce byl (derivát) B12 důležitý i ve štěpení MK s lichým počtem uhlíků, kde jsme potřebovali nějak zpracovat sukcinyl-CoA
- B12 je nejsložitější malá molekula, kterou přijímáme
- vazba kobalt-uhlík je pro jeho funkci velice důležitá (a je v přírodě velice neobvyklá)
- vazba je štěpena homolyticky \(\implies\) vznikají radikály \(\implies\) využití v reakci (B12 se chová jako generátor radikálů)
Pokud máme málo B6/B12 a nějakou špatnou alelu, může se nám v těle hromadit homocystein. To může souviset s Alzheimrem nebo s kardiovaskulárními problémy. Obecně je mnoho různých patologických stavů způsobeno hromaděním produktu (ať už je toxický, nebo ne) nad nějakou jeho únosnou mez.
Skupina NIH
- Tyr, Phe \(\rightarrow\) fumarát + acetoacetát
- reakční mechanismy jsou složité, ale metabolismus Tyr a Phe spolu souvisí (Phe hydroxylujeme na Tyr)
- pracují s molekulovým kyslíkem
- jako kofaktor mají biopterin, resp. jiný derivát pteridinu
- průběh
- použití kyslíku a nehemového železa k tvorbě oxyfenylového aniontu
- součástí je hydroxylace kofaktoru
- oxyfenolový aniont je použit ke torbě epoxidu, který se tvoří na původně aromatickém jádře
- oxyfenolový aniont se štěpí a výsledkem je tyrosin
- důležitá je odlišná pozice substituentu—došlo k migraci vodíku (viz barvy na obrázku níže)
- použití kyslíku a nehemového železa k tvorbě oxyfenylového aniontu
- průběh byl objeven v americkém NIH pomocí izotopového značení a nazván NIH přesmykem
AK jako prekurzory syntézy
- AK jsou prekurzory biologicky aktivních aminů, Gly je prekurzorem hemu
- glutathiol je důležitý pro udržování redukčních rovnováhách a transport AK, zejména těch se sírou
- např. dopamin, adrenalin, epinefrin, melanin
- jsou odvoditelné z Tyr a Phe prostřednictvím hydroxylačních a dekarboxylačních reakcí
- hydroxylační jsou závislé na pyridoxalfosfátu
- ty s kyslíkem používají NIH přesmyk
- způsobeno termosenzitivní mutací jednoho z enzymů syntézy melaninu
- deriváty pokožky blíže k tělnímu jádru jej netvoří, jen na čumáčku a tlapkách už se tvoří, protože je tam víc zima
- klíčový přenašeč v CNS
- je blízce příbuzný fenylethylaminu, což je podobně odvoditelná látka a vlastně nehydroxylovaná varianta dopaminu
- slavný mediátor, který doprovází stavy zamilovanosti
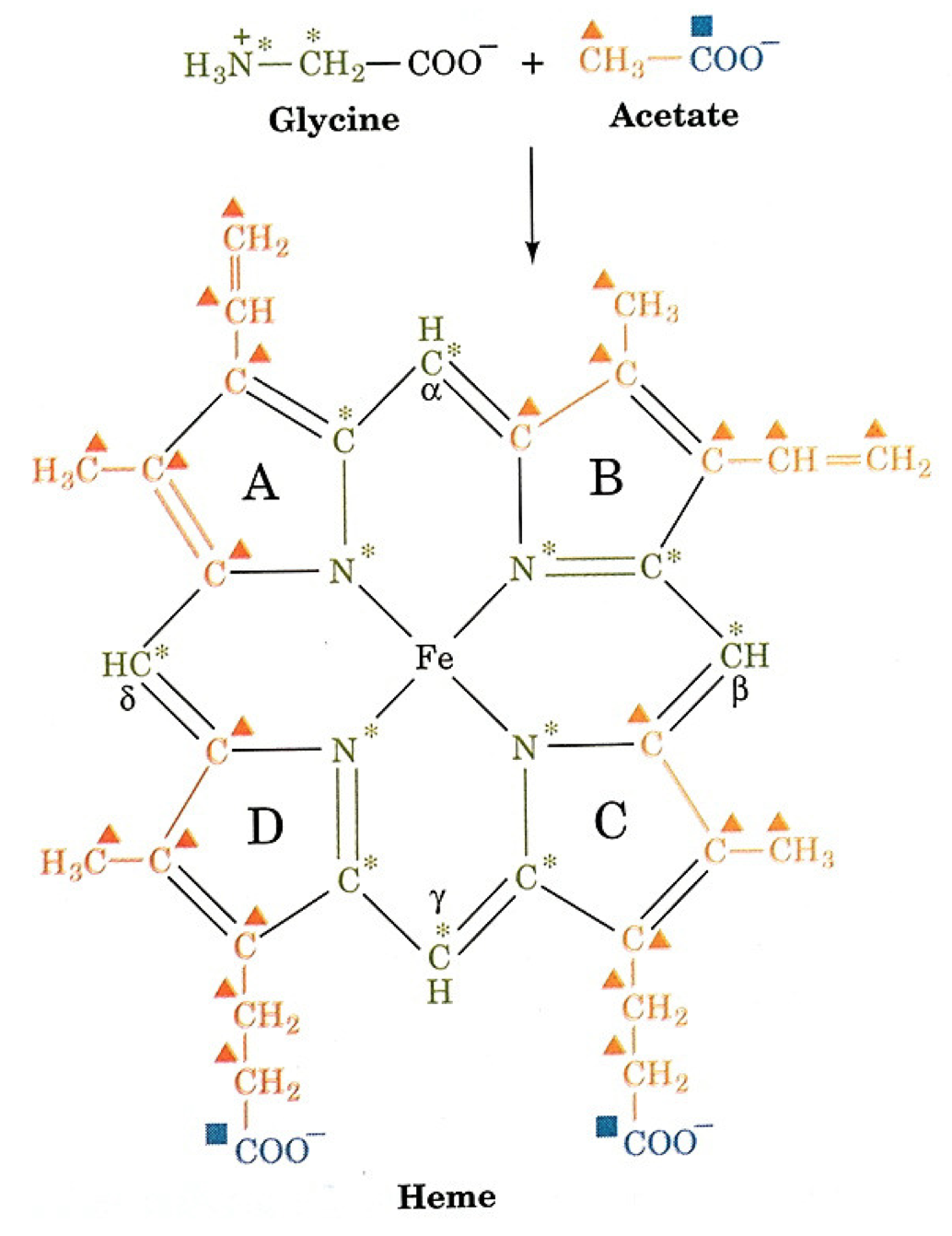
- jeho prekurzor je Gly
- všechny čtyři dusíky pyrolových jader jsou z Gly, kromě toho už tam jsou jen acetylové skupiny a dvě karboxylové skupiny
- složitá struktura je vytvořena šesti reakcemi
- i zde platí, že intermediáty jsou nebezpečné—změny jejich koncentrací se projevují patologicky
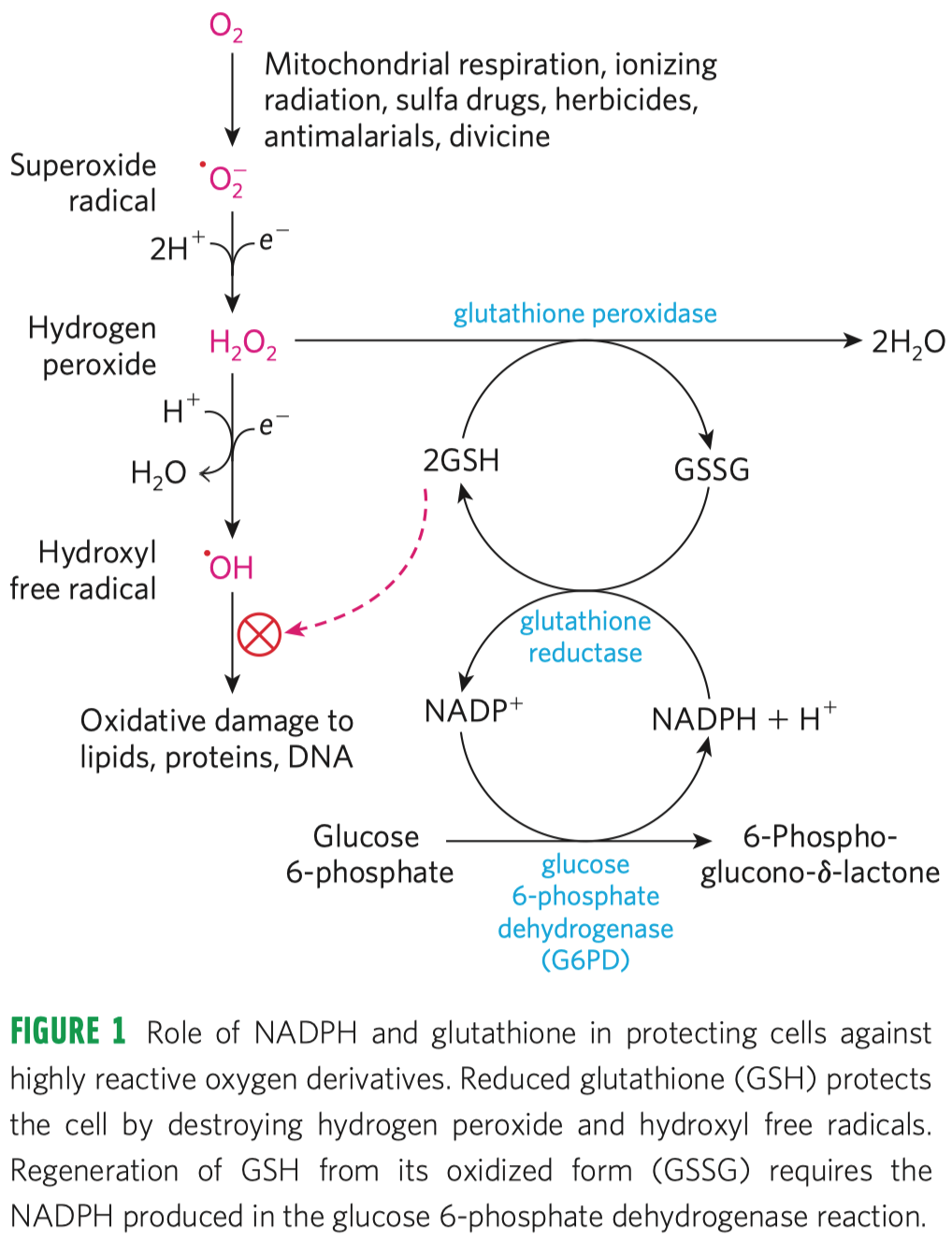
- γ-glutamyl-cysteinyl-glycin
- vytvořen izopeptidovou vazbou mezi Glu (karboxylová skupina) a Cys (aminoskupina)
- účastní se jednoho cyklu, u nějž je třetí reakce lokalizovaná na cytoplazmatické membráně (viz obrázek níže)
- aktivní centrum glutathiolu naváže AK se sírou z extrabuněčného prostoru
- přenese svůj náklad na Glu
- AK se uvolní do buňky, s ní se uvolní i cysteinoglycin
- glutathiol je resyntetizován
- vzhledem ke své
\(\ce{-SH}\) skupině a schopnosti tvořit dimer je kofaktorem enzymů, které se starají o inaktivaciROS - viz obrázek výše
- glutathiolperoxidáza + redukovaná forma glutathiolu \(\rightarrow\) oxidovaný dimer glutathiolu, zároveň ROS \(\rightarrow\) alkohol
- glutathiolreduktáza se stará o jeho redukci
- důležitý je i pro reakce thioltransferáz, které regulují počet
\(\ce{S-S}\) můstků v proteinech - v neposlední řadě se glutathion-S-transferáza účastní syntézy leukotrienů
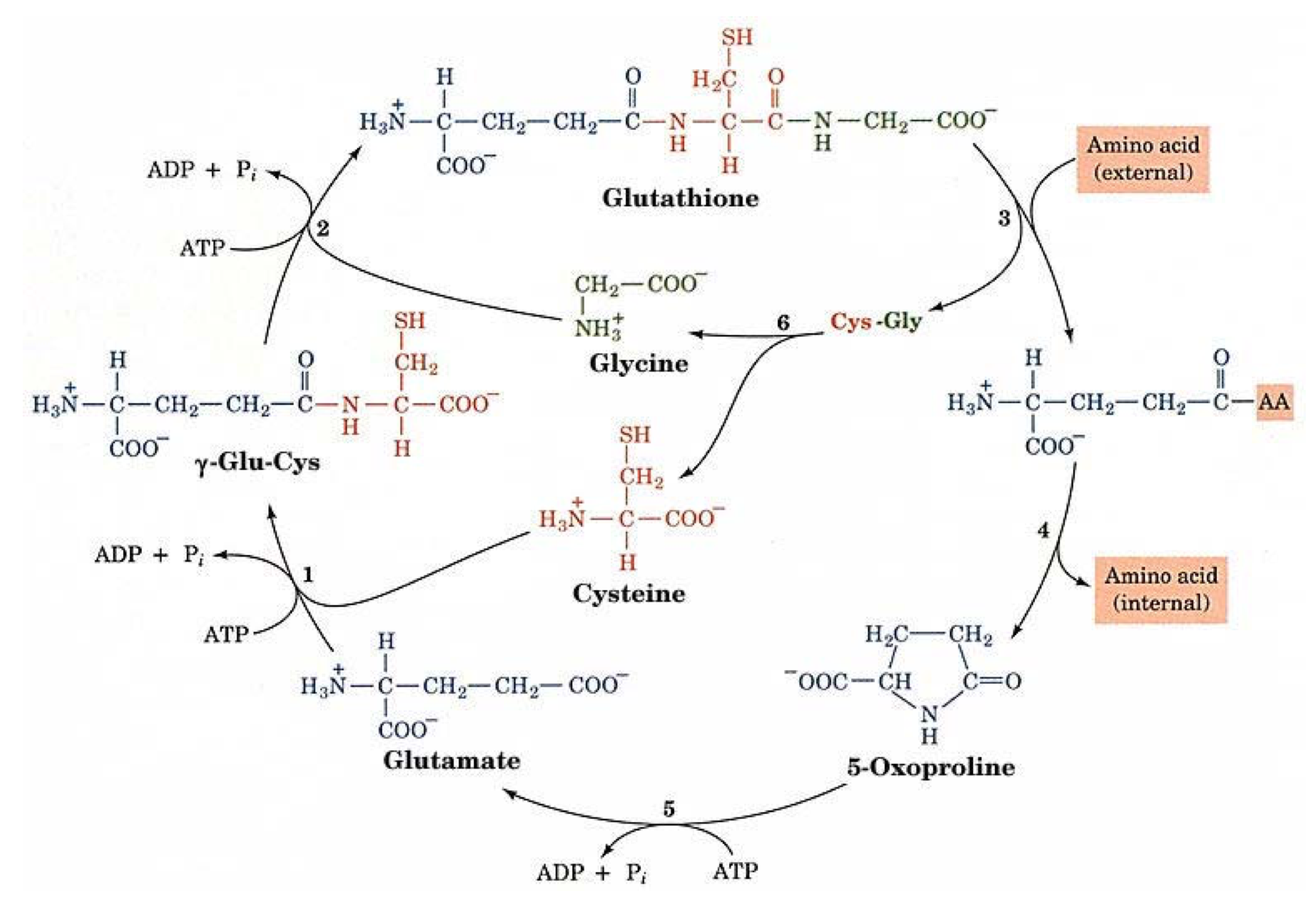
Syntéza AK
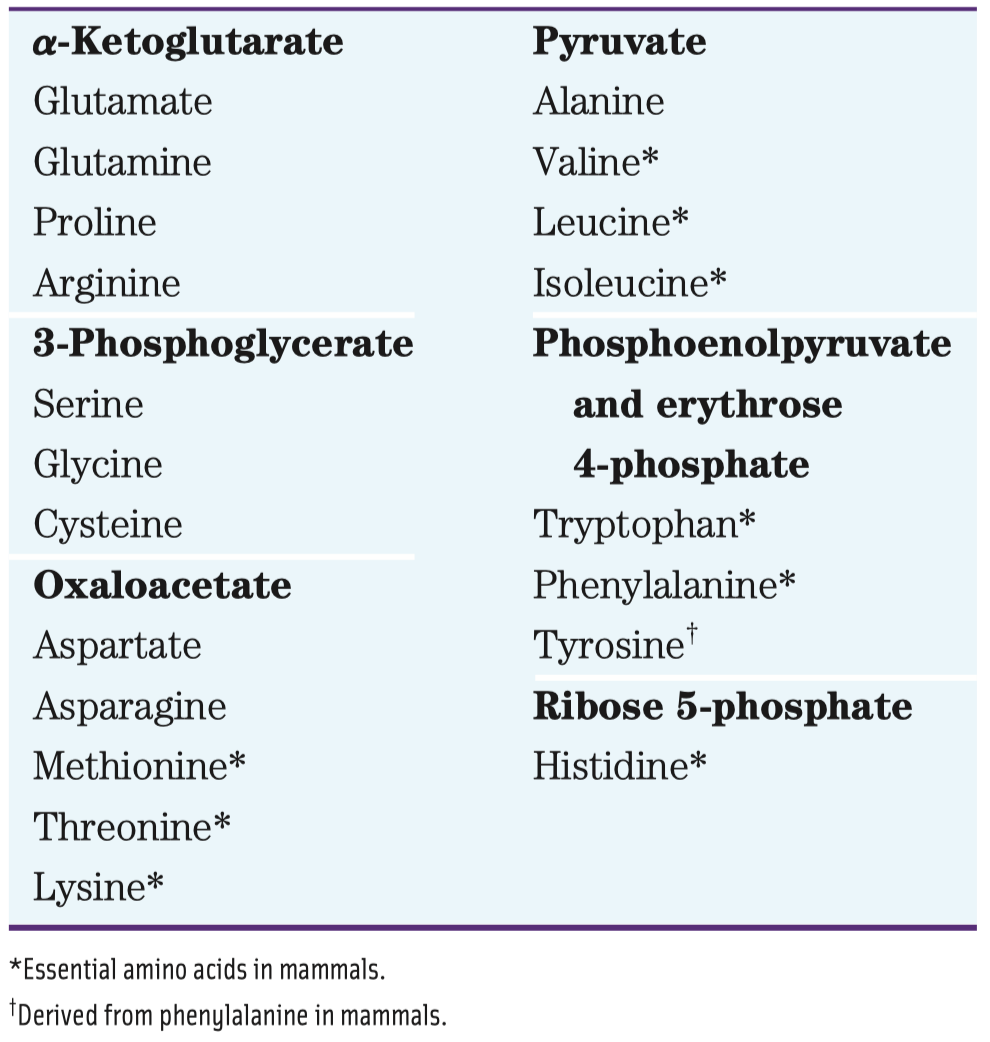
- vlastně všechny ty složitější
- očividně se vyplatí spoléhat na potravu a ušetřit na dlouhých a složitých metabolických drahách
- aminoskupina v AK je esenciální živina, neumíme ji syntetizovat
- AK se nikdy nesyntetizuje z nějaké ketokyseliny
V trusu malých kolibříků bylo nalezeno mnoho amoniaku, chvíli se myslelo, že si s ním malí ptáčci někdy vystačí jako s odpadním materiálem místo kyseliny močové. Ukázalo se ale, že má tento druh kolibříků speciální mikrobiom, který z kyseliny močové zpětně resorbuje materiál, který poté kolibřík zpracovává, a vylučuje amoniak.

Metabolismus nukleotidů
- všechny buňky nukleotidy syntetizují (s výjimkou speciálních případů buněčných typů)
- mají evolučně konzervované, společné dráhy
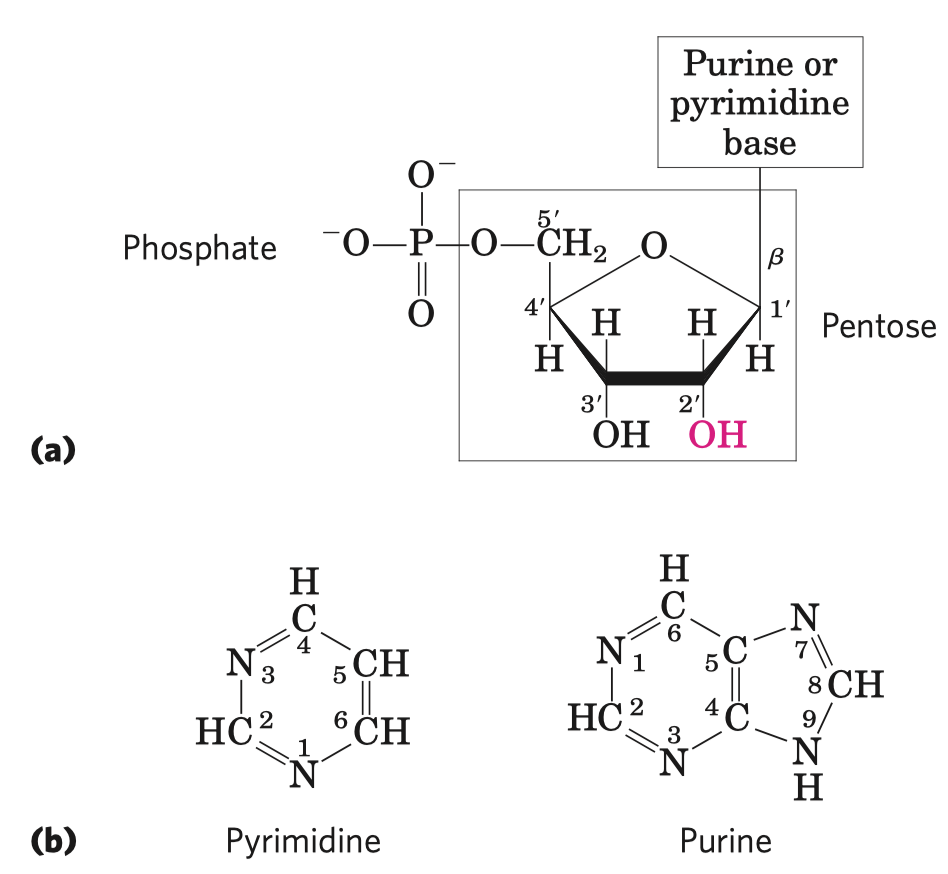
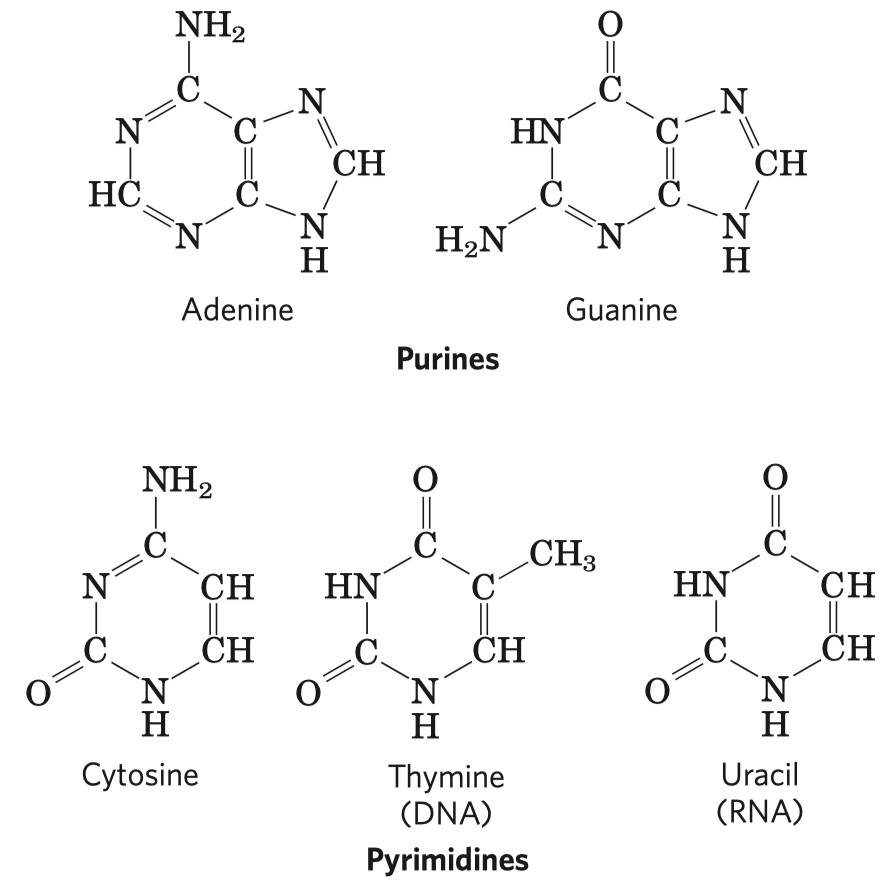
- báze jsou na (deoxy)ribózu vázány C1-glykosidickou vazbou
- nukleotidy se vážou 5’-3’ fosfodiesterovou vazbou, takto tvoří kostru DNA i RNA
- v případě DNA vzniká dvoušroubovice, kde báze v komplementárních patrech interagují vodíkovými vazbami
- jak je vidět, odlišují se puriny substituenty na C2 a C6 (oxo, amino) a pyrimidiny na C2 a C4 (oxo, amino) popř. methylací na C5
- báze + cukr = nukleosid, fosforylovaný nukleosid = nukleotid (viz obrázek níže)
Nukleotidy se mohou vyskytovat v keto a enol tautomerické formě.
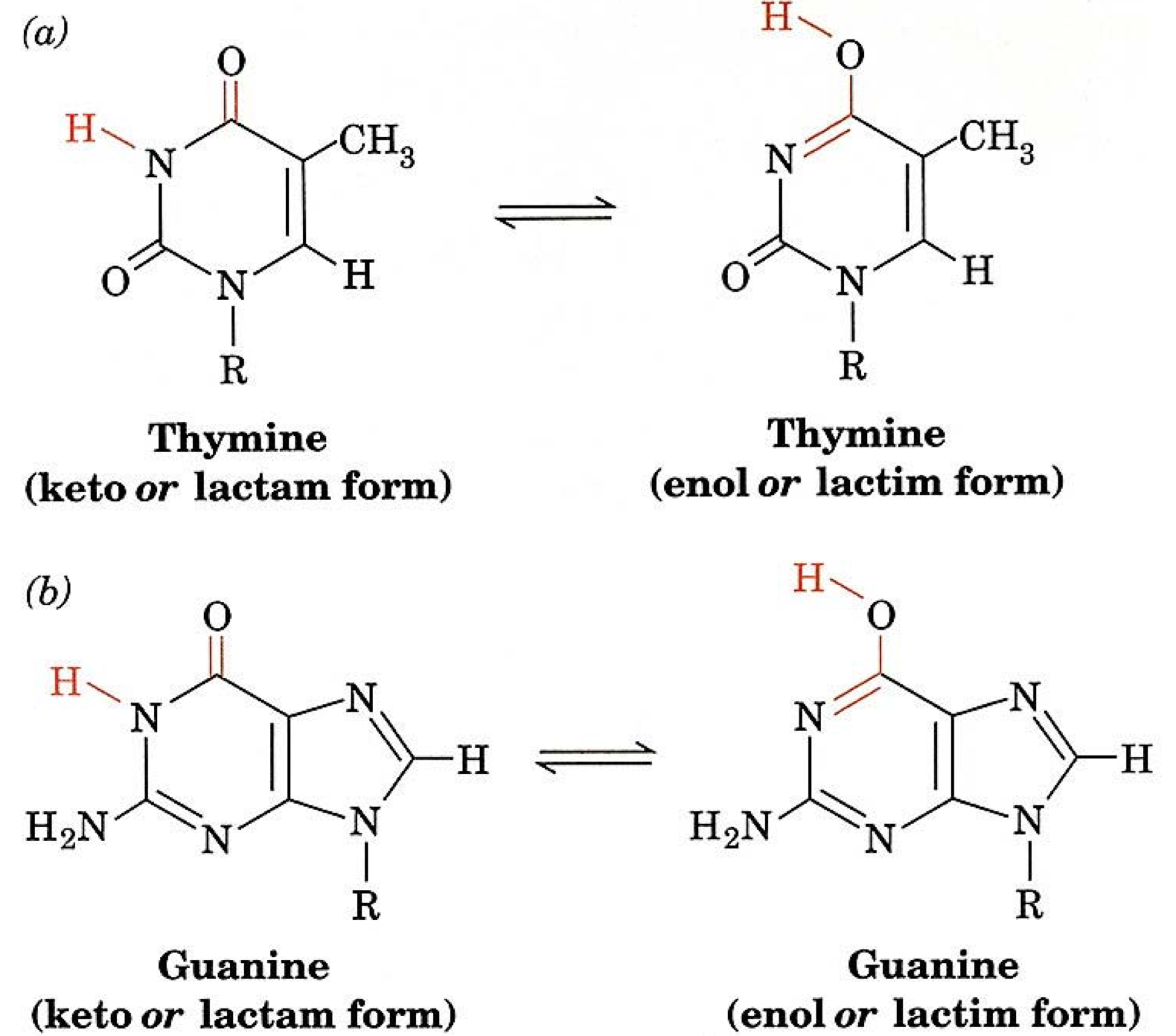
- 8-oxo derivát xanthinu, celkově tedy 2,6,8-trioxo derivát purinu
- produkt metabolismu purinových bazí, zejména vylučována ptáky a plazy
- může být degradována až na močovinu a amoniak, různí živočichové ji vylučují v různých fázích této přeměny
- kyselina močová
- alantoin
- zde končíme hlavně u některých druhů savců
- kyselina alantolová
- glyoxylová kyselina
- močovina
- zde končíme u chrupavčitých ryb či obojživelníků
- degradace močoviny na volný amoniak
- typicky jen bezobratlí, amoniak je jinak problematický
- dále může být tento dusíkatý odpad dále zpracován mikrobiomem
Derivátem xanthinu je i kofein (1,3,7-trimethylxanthin).
Syntéza nukleotidů
Prekurzorem pro pyrimidiny i puriny je ribóza-5-fosfát, kterou získáme v pentózofosfátové dráze.
Syntéza purinů
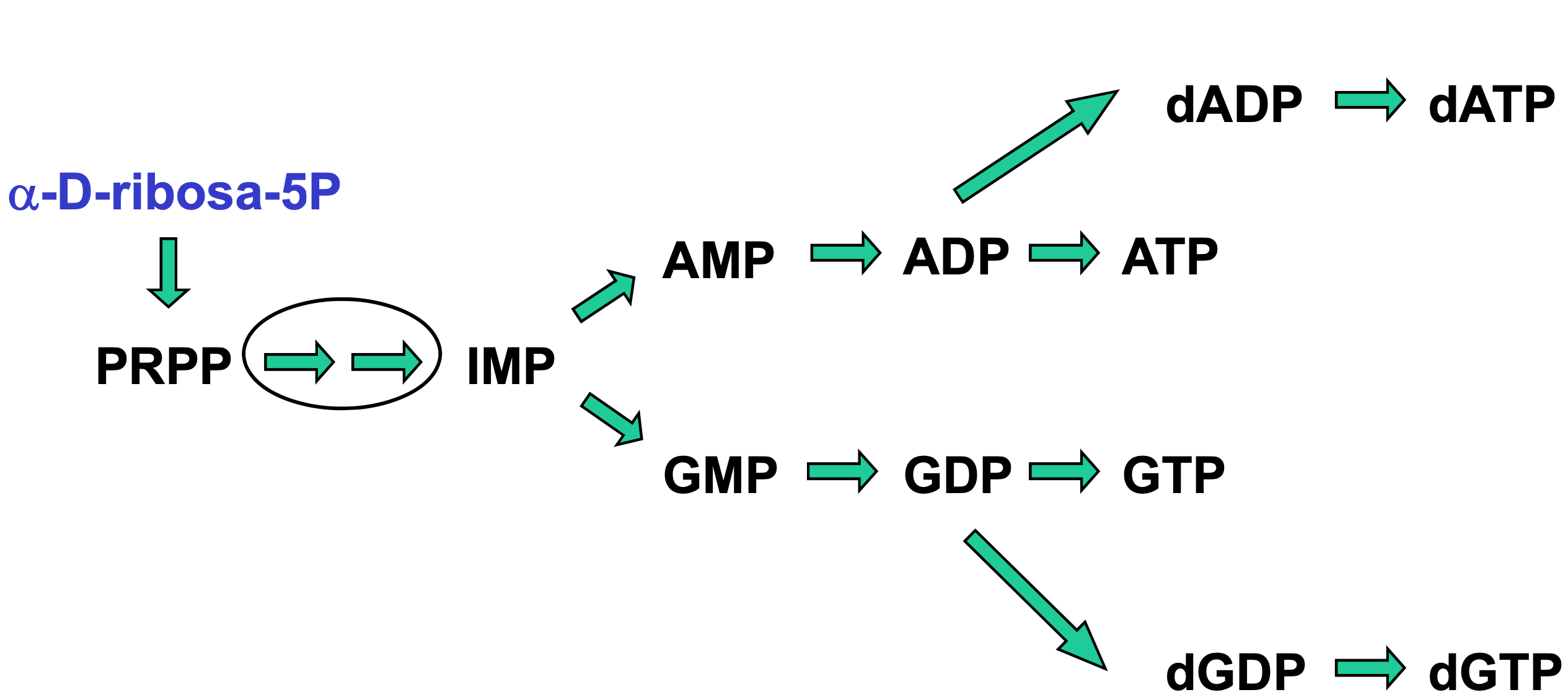
- potřebuje syntetizovat ATP, GTP, dATP, dGTP
- do dráhy vstupuje α anomer, 5-fosforibóza-pyrofosfát (dále jen PRPP)
PRPP \(\rightarrow\) IMP
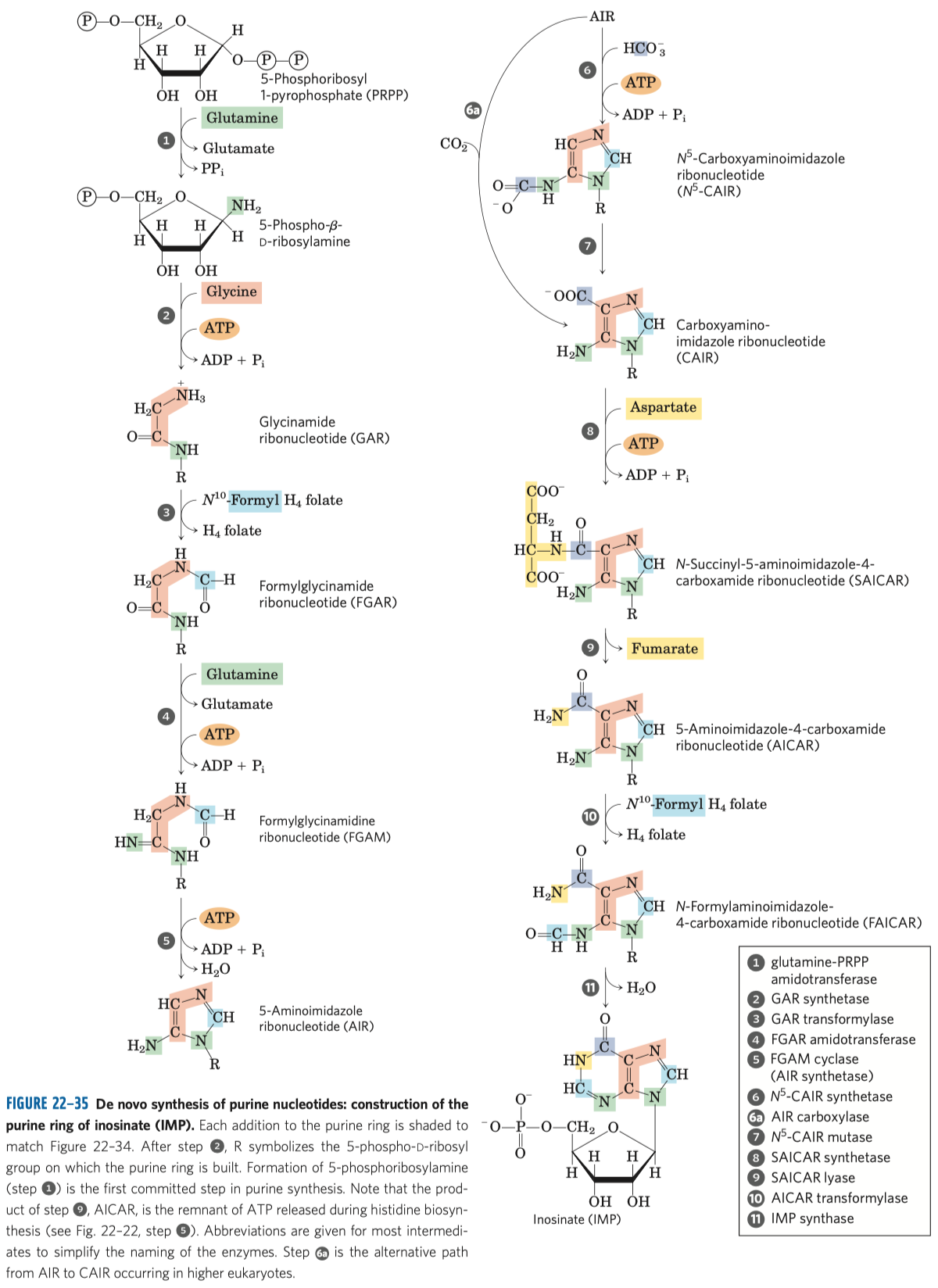
- má charakter lega (viz obrázek výše a níže)
- hypoxantin je stavěn postupně na N9, atom po atomu
- zásadní rozdíl s pyrimidiny, kde nejdřív vznikne nějaká báze a pak se připojí na cukr
- reakce jsou poháněny ATP
- prekurzory (i.e. z čeho se skládá finální hypoxanthin)
- Gln, které dodává dusíky, N9 a poté i N3
- Gly, z něho máme uhlíky
-
THF , ten přinese formylovou skupinu (další uhlíky) - Asp, které se rozloží na fumarát a jeho aminoskupina se stane součástí hypoxanthinu
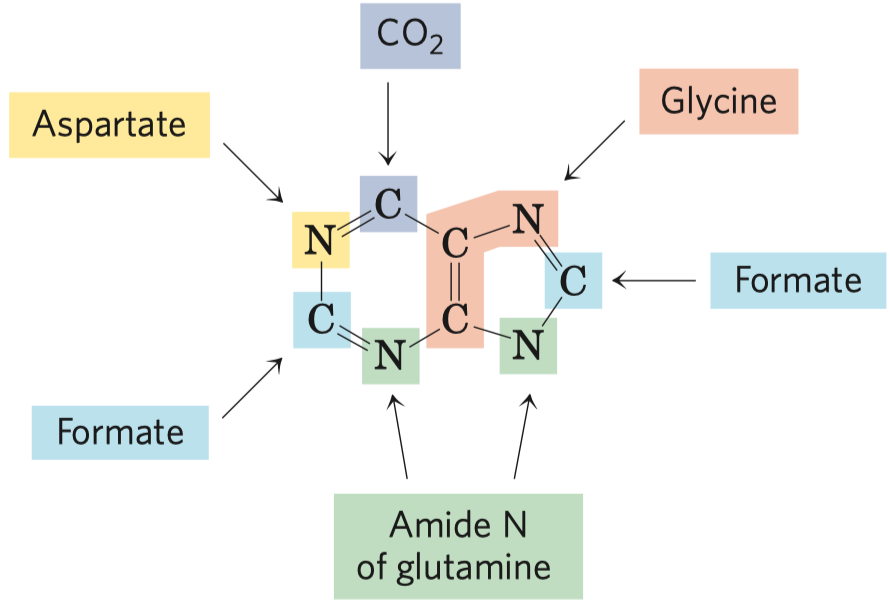
- intermediáty jsou často nestabilní, mohly by se rozložit než by stihly zreagovat
- např. 5-fosforibozylamin je nestabilní
- dvě možnosti řešení
- chanelling, aktivní centrum enzymu, kde nestabilní intermediát vzniká, je kanálem spojeno s aktivním centrem následujícího enzymu
- nebo se enzymové aktivity stávají součástí jednoho peptidového řetězce
- podobně jako u syntézy MK
- zde (u živočichů): reakce [3, 4, 6], reakce [7, 8] a reakce [10, 11]
- v obou případech spolu komunikují a bezprostředně si produkty předávají a ty se do cytoplazmy ani nedostanou
IMP \(\rightarrow\) AMP/GMP
- reakce používají Asp k náhradě oxoskupiny aminoskupinou
- syntézu AMP pohání GTP, syntézu GMP pohání ATP
- je to přesně do kříže, význam pro regulaci
- obě reakce se tím pádem vzájemně podporují
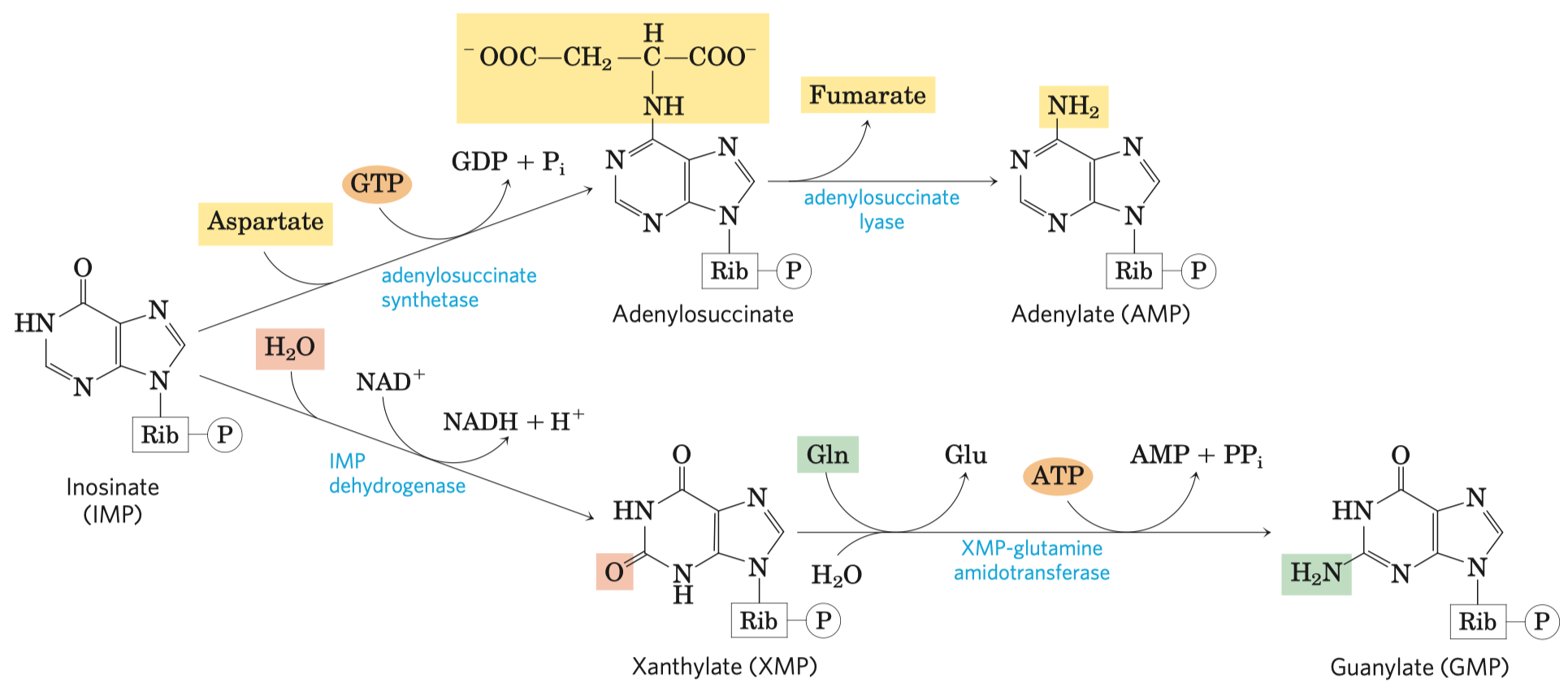
AMP a GMP poté slouží jako inhibitory přechozích reakcí.
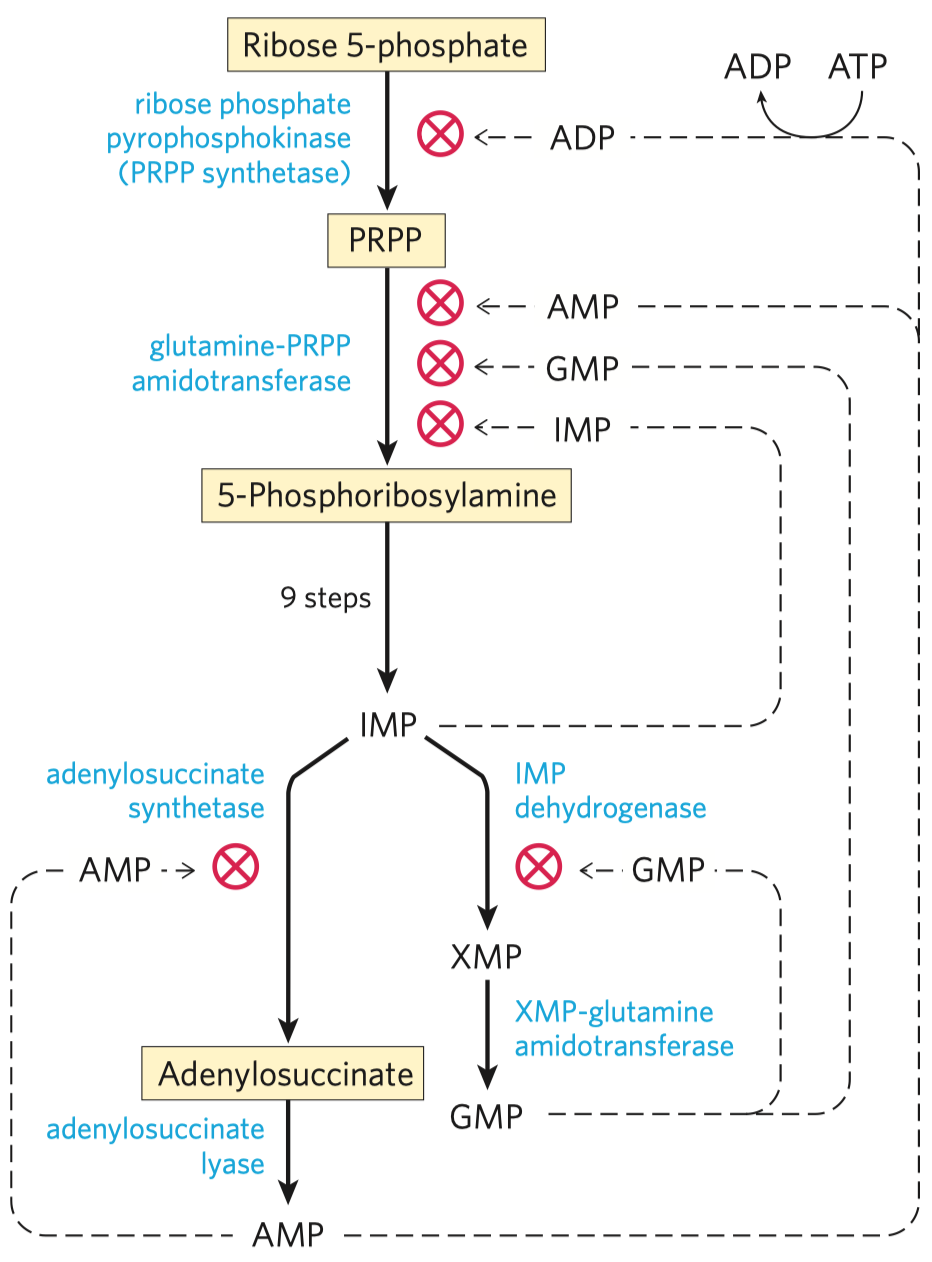
AMP/GMP \(\rightarrow\) ADP/GDP
- katalyzováno nukleosid-monofosfátkinázami
- jsou specifické pro danou bázi
- dané kináze ale bude jedno, zda pracuje s normální, nebo deoxy bazí
- syntéza probíhá de novo (z jednoduchých částí, nejedná se o recyklaci), stojí tedy energii
- energii dodává ATP, které tedy není jen prekurzorem, ale také energetickým platidlem
- dojde k reakci AMP \(\rightarrow\) ADP, a zároveň ATP \(\rightarrow\) ADP
- skončíme tedy se dvěma ADP
ADP/GDP \(\rightarrow\) ATP/GTP
- katalyzováno nukleosid-difosfátkinázami
- jsou oligospecifické, fosforylují více věcí
- dané kináze bude jedno, zda pracuje s normální, nebo deoxy bazí
Obecná rovnice vypadá následovně:
ATP pochází z egergetického metabolismu (z OF).
Syntéza pyrimidinů
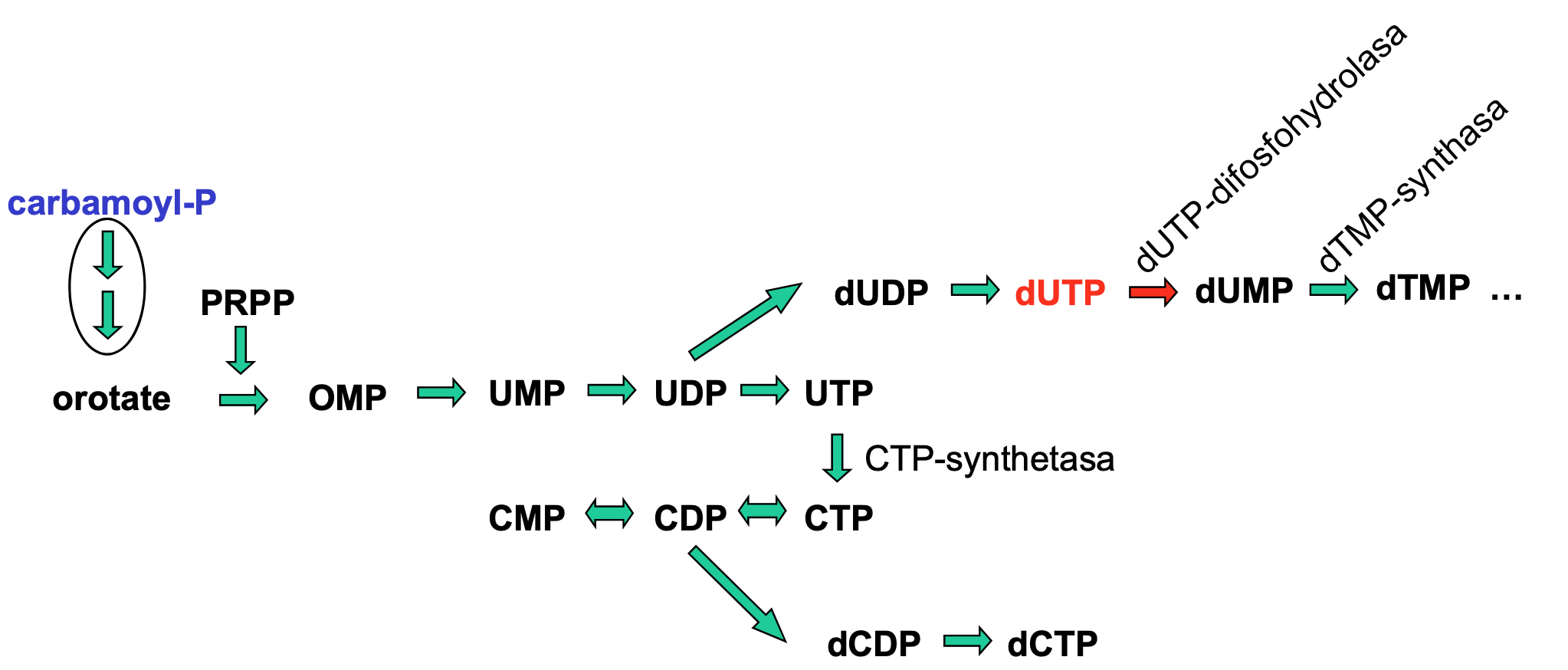
- potřebuje syntetizovat UTP, CTP, dTMP, dCTP
- na rozdíl od purinů je nutné postavit celou dusíkatou strukturu a pak ji přenést na ribózu
- prekurzory jsou tedy jen tři: kostra Asp, Glu a
\(\ce{HCO3-}\)
- prekurzory jsou tedy jen tři: kostra Asp, Glu a
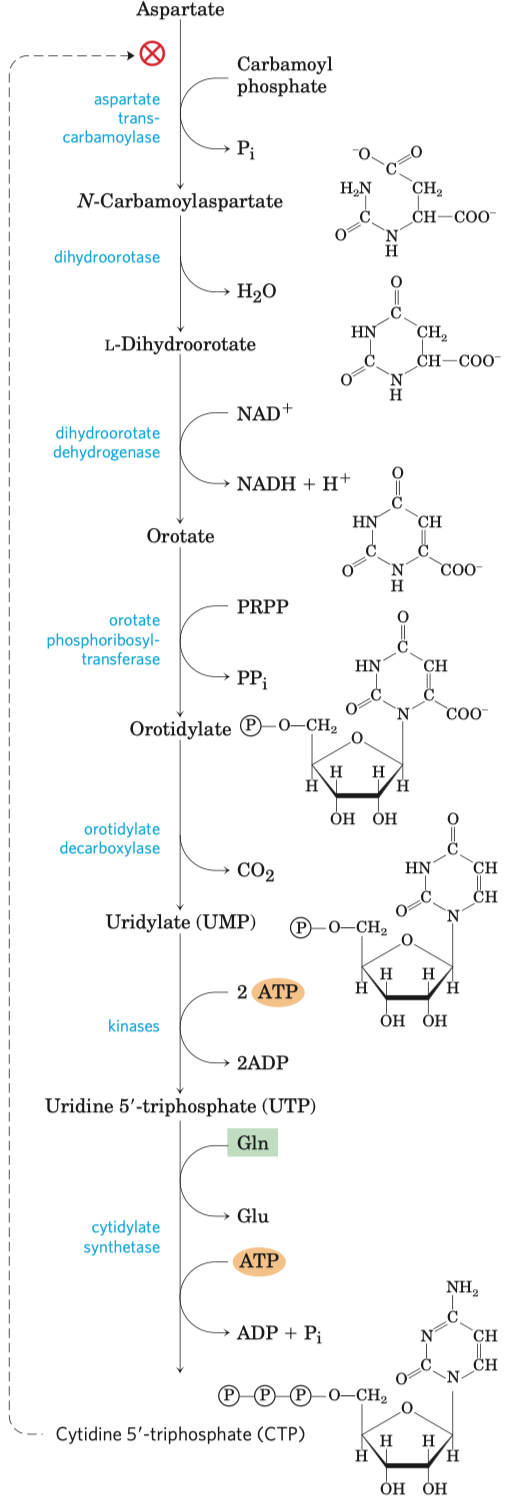
prekurzory \(\rightarrow\) karbamoyl-P
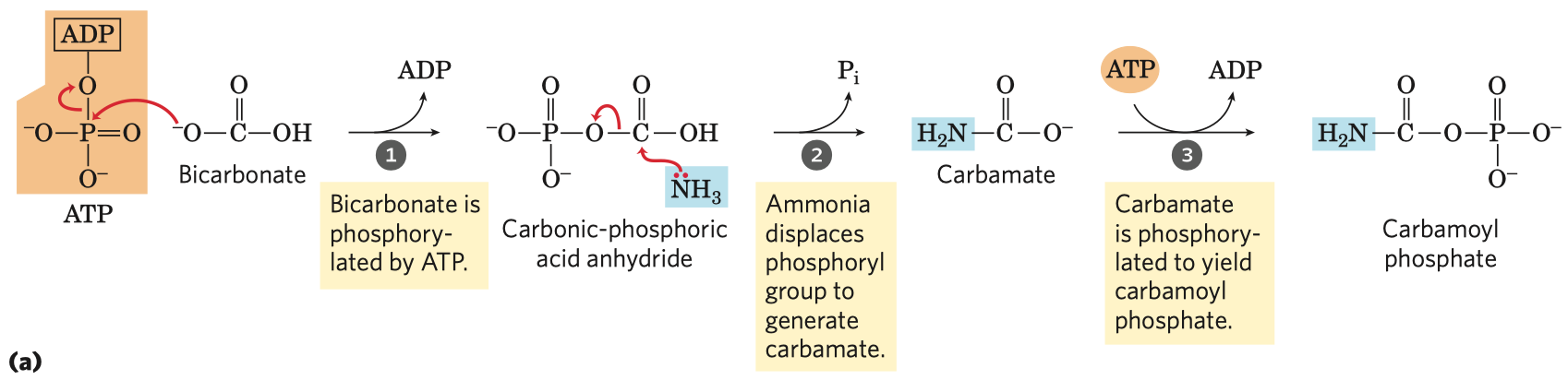
- katalyzováno karbamoyl-P-syntetázou II
- reakce probíhala už v
mch v játrech, tam ji katalyzovala karbamoyl-P-syntetáza I
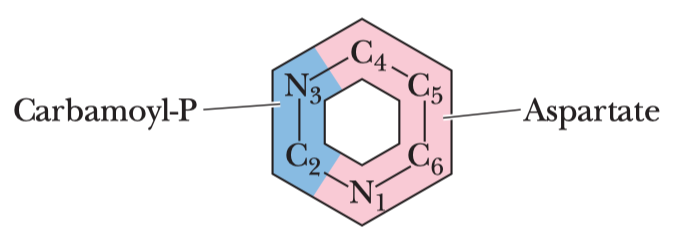
karbamoyl-P \(\rightarrow\) orotát
- karbamoyl-P reaguje s Asp \(\rightarrow\) vzniká konjugovaná sloučenina \(\rightarrow\) cyklizace a dehydrogenace
- probíhá na membráně
mch - potřebuje ubichinon z dýchacícho řetězce v
mch - využívá systém dýchacího řetězce k ekvilibraci, reoxidaci ubichinonu
- potřebuje ubichinon z dýchacícho řetězce v
orotát \(\rightarrow\) UMP
- orotát je přenesen na ribózu
- jako bázi můžeme ribóze nabídnout třeba i uracil, podle toho vznikne odpovídající nukleotid
- tedy nemusíme syntetizvat vše de novo, ale buňka umí využít něco, co už má (tzv. salvage)
- u dekarboxylací AK jsme potřebovali B6 (elektronovou jímku), zde je však něco jiného, unikátního
- využívá se těsné vazby mezi enzymem a celou molekulou substrátu přěsně do aktivního místa
- tím, jak se na sebe molekuly natlačí, destabilizuje se vazba (protože se přiblíží k jiné záporné skupině) \(\rightarrow\) jde lehce štěpit
- produkty UTP a CTP inhibují první reakci syntézy, naopak ATP ji reguluje pozitivně
- u prokaryot UTP/CTP inhibují spíše tu transferázovou reakci, ale výsledek je podobný
- prokaryotická Asp-transkarbamoyláza je principem typické alosterické regulace
UMP \(\rightarrow\) CTP
- vnesení amidové skupiny z Gln
- potřebujeme aktivaci pomocí ATP
dUDP \(\rightarrow\) dTMP
Pro vznik dUDP (a obecně dčehokoli) viz oddíl syntéza deoxyribonukleotidů.
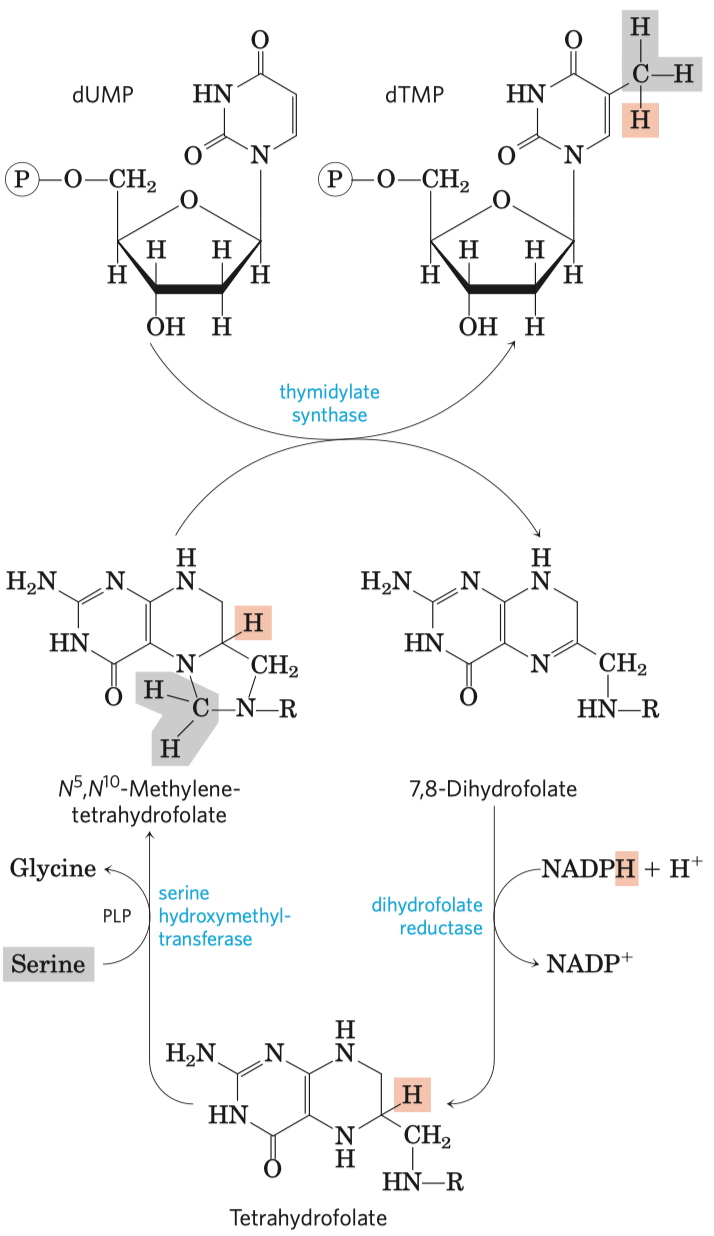
- dUDP \(\rightarrow\) dUTP \(\rightarrow\) dUMP +
\(\ce{PP_i}\) - dUTP je přítomno velice málo, rychle se štěpí, jinak by se inkorpovalo do DNA a to nechceme
- v reakci dUMP \(\rightarrow\) dTMP je převeden
\(\ce{CH2}\) z methylenu-THF , vznikáDHF DHF je redukován\(\ce{NADPH + H+}\) naTHF - zde jsou mířena různá cytostatika a antibiotika
- když dokážeme dráhu zablokovat, buňka se nemůže dělit (protože nemůže syntatizovat vitální část DNA)
Syntéza deoxyribonukleotidů
- aplikovatelná na puriny i pyrimidiny
- dochází k výměně redukčních ekvivalentů
- katalyzuje ji ribonukleotid-reduktáza třídy I
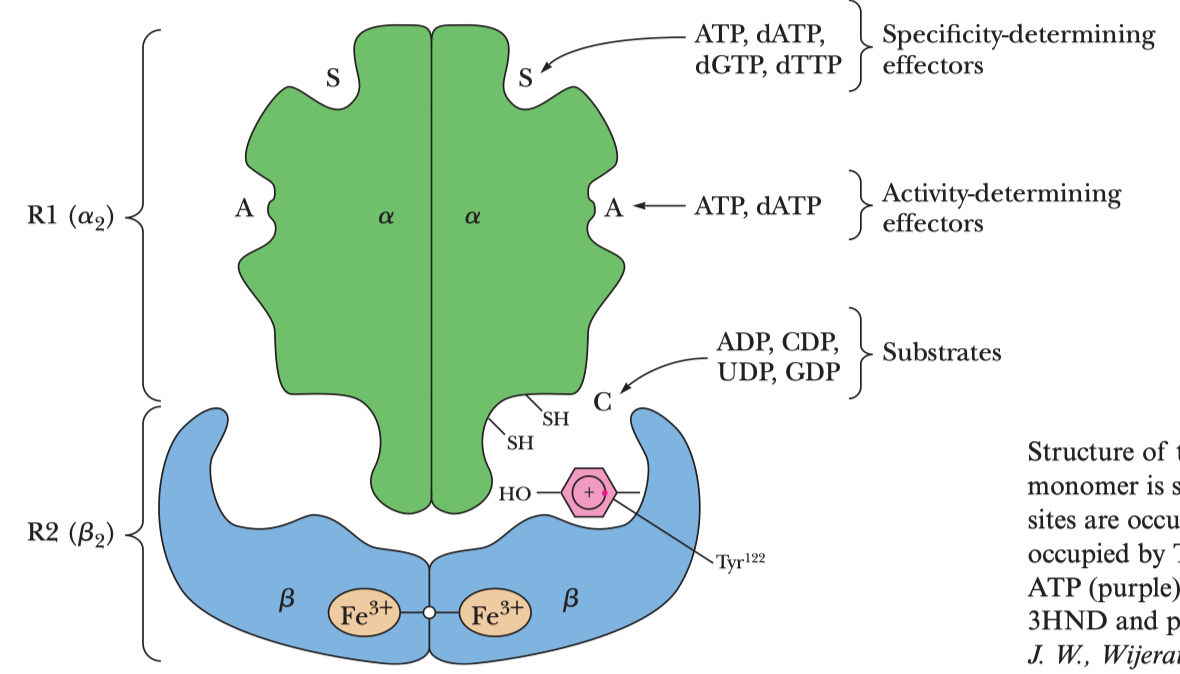
- třída III je typická pro anaerobní prokaryota
- třída II je typická pro fakultativní anaeroby
- třídu I mají všichni ostatní
- jsou nejspíše stejného původy, nejprve byly čistě anaerobní (III) \(\rightarrow\) schopnost fungovat i aerobně (II) \(\rightarrow\) čistě aerobní (I)
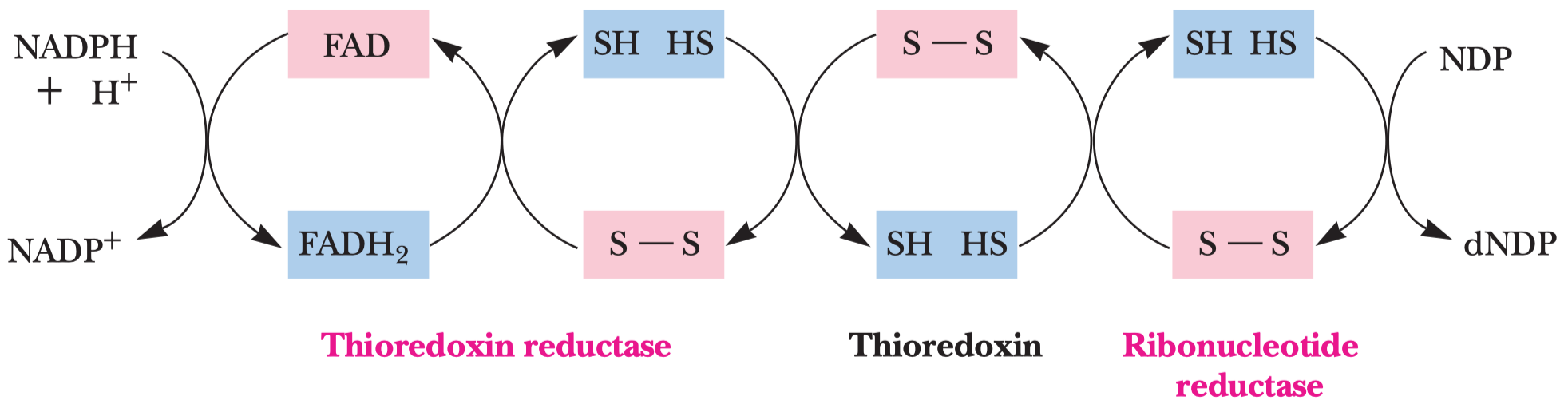
- redukuje NDP na dNDP
- je poté potřeba enzym samotný (resp. jeho oxidovanou část, thioredoxin) zpět redukovat, o to se stará NADPH
- má centrum s železem ve III. oxidačním stupni
–umí provést redukci kyslíku za vzniku Tyr radikálu
- Tyr radikál vzniká v jedné z podjednotek enzymu a pak se to využívá dál v reakci
- radikál vzniká na R2, R1 zprostředkovává regulace
- radikál může být generován homolytickým štěpením; zatím se přesně neví, ja kto třída I dělá
- kandidátem je např. vazba
\(\ce{Co-C}\) na derivátu vitamínu B12
- kandidátem je např. vazba
- radikál může být generován homolytickým štěpením; zatím se přesně neví, ja kto třída I dělá
- radikál je stabilní, protože vzniká uvnitř, chráněn proti okolí
- radikál je vyměňován s dalšími skupinami
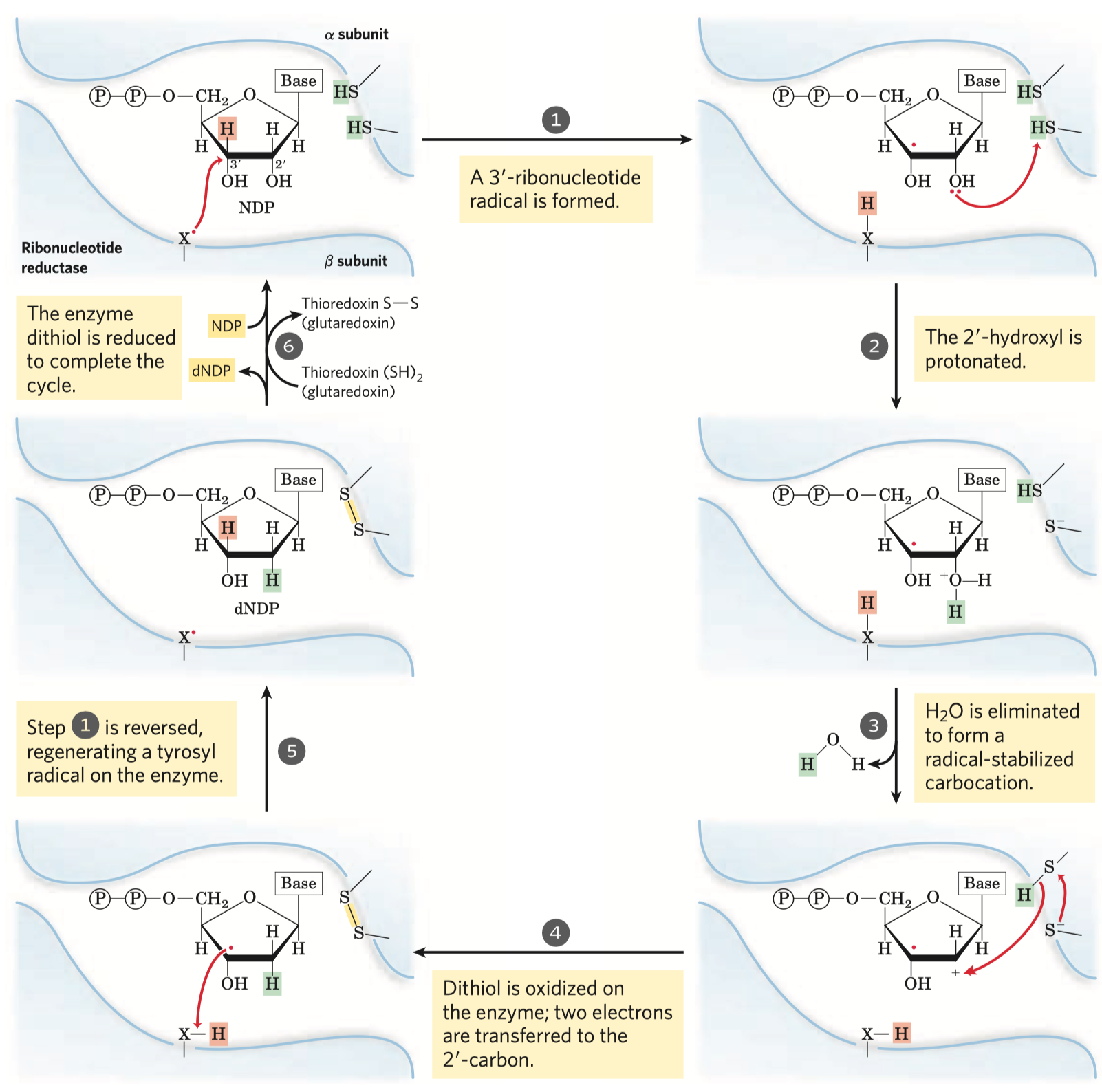
Degradace nukleotidů
Zajímá nás především katabolismus purinů.
- NTP \(\rightarrow\) NMP
- NMP hydrolyzovány na nukleosidy
- štěpeny v reakci fosforylázy
- báze se uvolňuje a pokračuje dál katabolickou drahou
- ribóza je recyklována jako ribóza-1-fosfát, z toho můžeme ve fosfomutázové reakci získat ribóza-5-fosfát
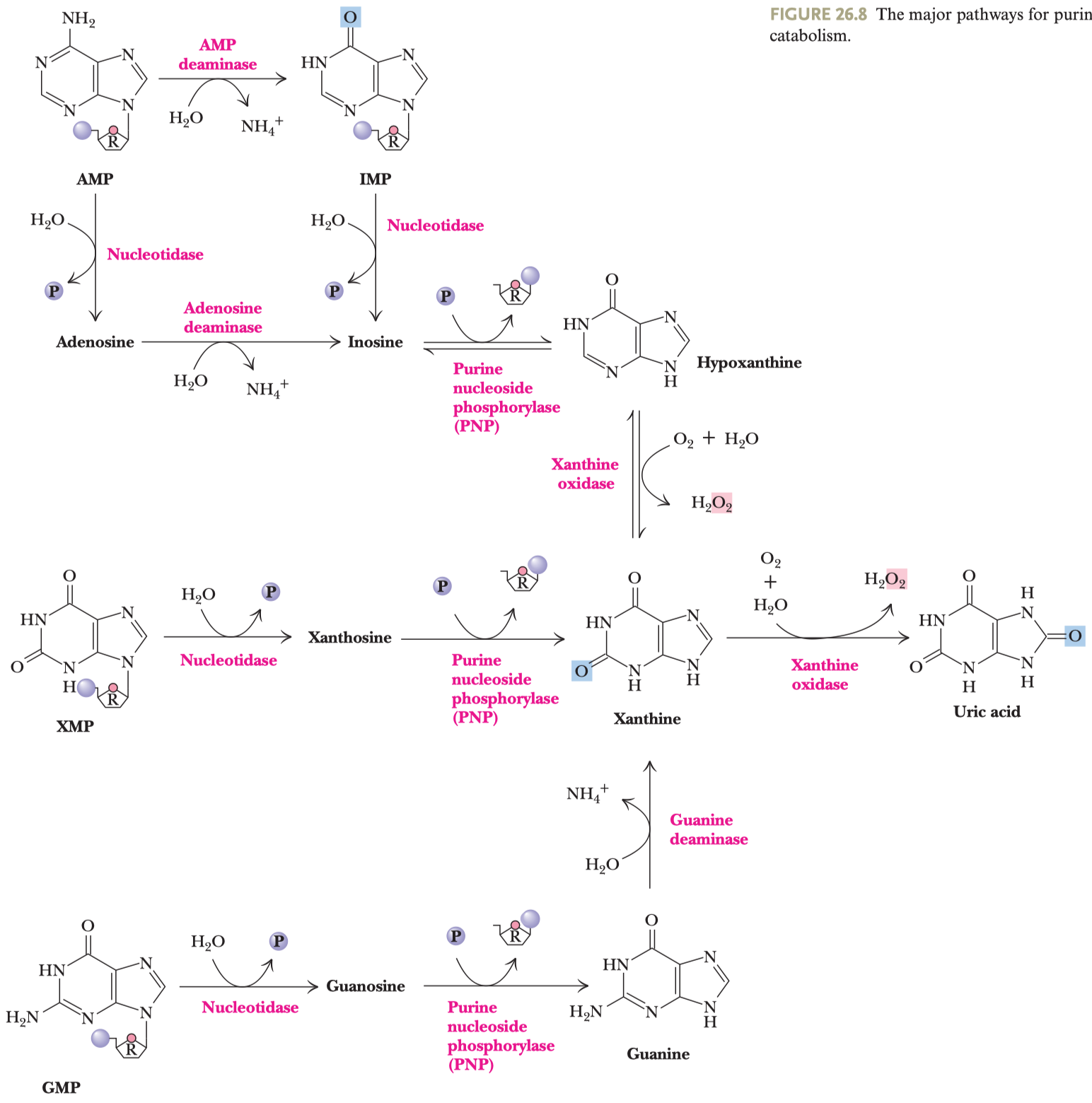
Fosforylázové reakce (ty s PNP) jsou zajímavé, protože pokud v nich nějaký enzym nefunguje, výsledky mohou být fatální. PNP je avšak také cílem chemoterapeutických zásahů při léčbě autoimunitních či leukemických onemocnění.
AMP někdy vybočuje z mechanismu uvedeného výše, místo toho se účastní cyklu, který doplňuje intermediát KC.
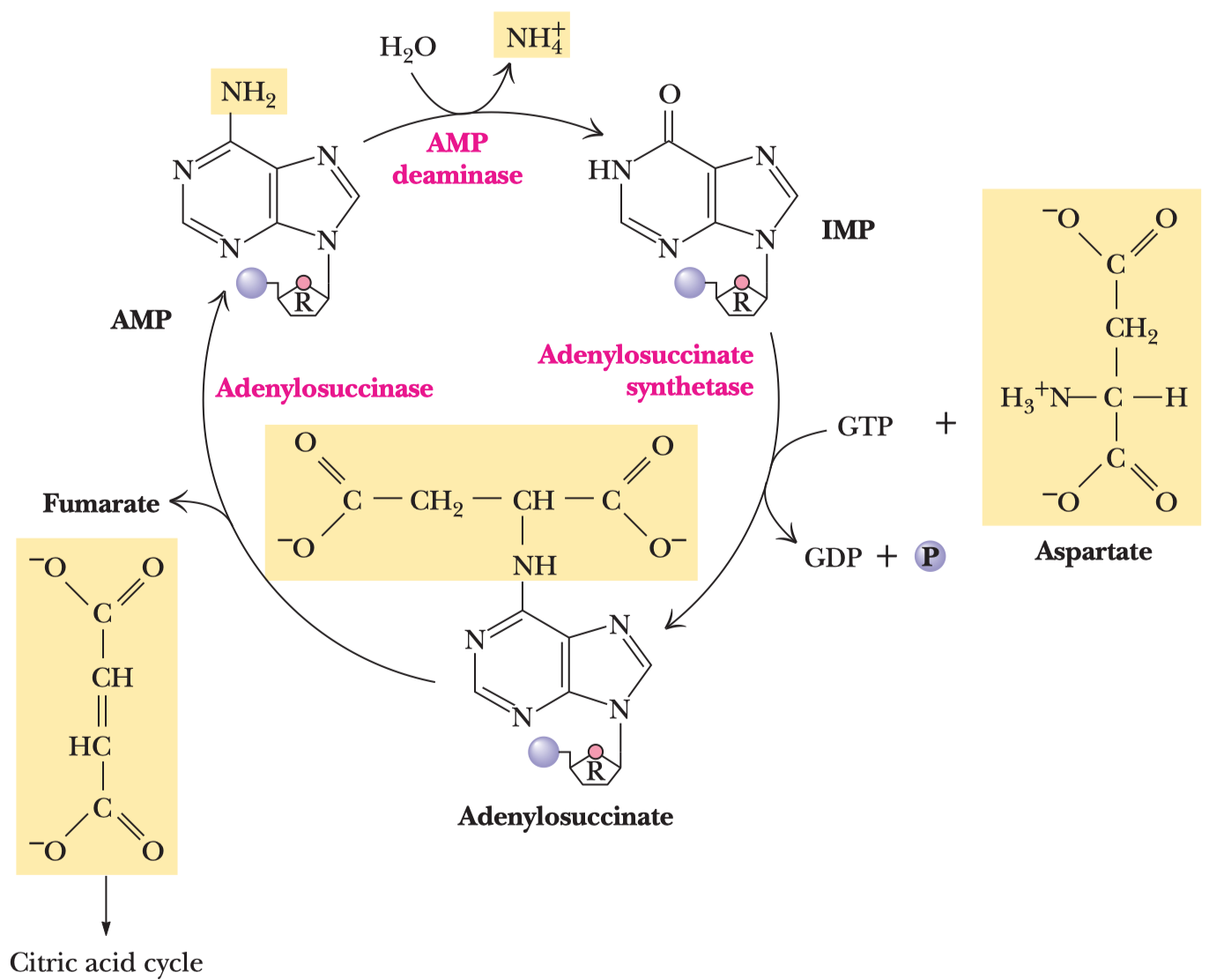
- katalyzuje pouze oxidativní deaminaci adenosinu
- pokud nefunguje, adenosin se hromadí
- hromadění adenosinu
- zpětnovazebně dochází k dalším změnám koncentrací nukleotidů v metabolismu, např. dATP
- dochází mimo jiné k inhibici ribonukleotid-reduktázy
- dělící se buňky mají problém, což se projeví kombinovanou imunodeficiencí
- léčba: genetická terapie nebo dodávání funkční adenosin-deaminázy
Mutace AMP-deaminázy vede k deficienci svalové myoadenylátdeaminázy.
Výsledkem tohoto oxidativního metabolismu je kyselina močová (kyselina, protože odpovídající enolový tautomer slabě disociuje).
- nukleosid je defosforylován na nukleosid-monofosát
- štěpení, uvolnění ribózy-1-fosfátu a báze
- následuje metabolismus U nebo T na malonyl-CoA
- viz obrázek výše
- nikoliv oxidativní, ale reduktivní krok umožní pak linearizovat molekulu
- je zde potřeba vitamín B12 (druhé z těch dvou použití, o kterých jsme hovořili)
- báze je odbourávána, u pyrimidinových je to reduktivní odbourávání na dvouhulíkaté zbytky